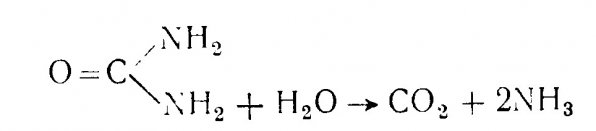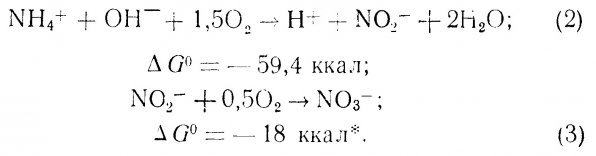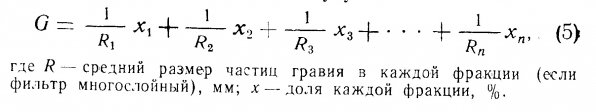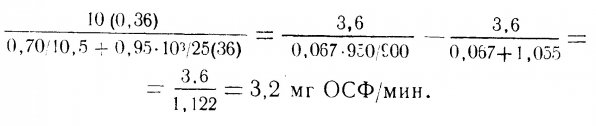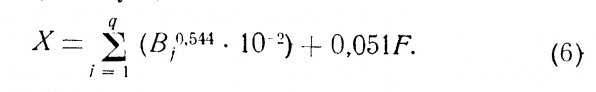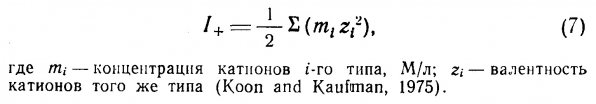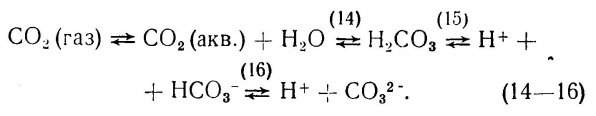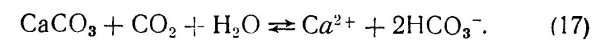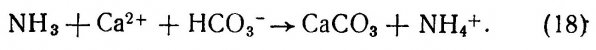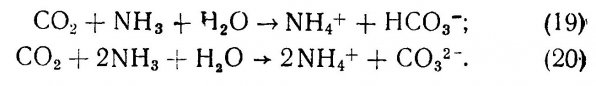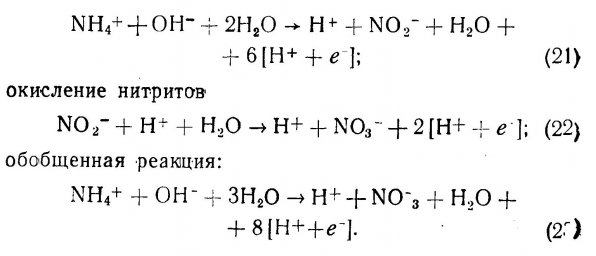Содержание рыб в замкнутых системах С. Спотт

Представляем вашему вниманию замечательную книгу Стефана Спотта «Содержание рыбы в замкнутых системах», которая была издана в СССР аж 1983 году.
Мы решили «реанимировать» книгу – перевести ее в печатный текст, поскольку в интернете она сохранилась лишь в устаревшем djvu-формате. Но самое главное, не смотря на то, что прошло уже очень много времени с момента издания книги, она во многих моментах не потеряла свою актуальность и, по сути, является полноценным базисом для нас – аквариумистов.
В книге, автор делает упор на морскую аквариумистику, но она актуальна и для пресноводного аквариума. Книга отвечает на многие краеугольные вопросы аквариумистики, раскрывает их не только теоретически, но практически – опираясь на научные работы, опыты и исследования. Надеемся, что книга будет интересна и полезна для вас! Приятного чтения.
Содержание:
Глава 1 Биологическая очистка воды.
1.4. «Сбалансированный» аквариум.
1.5 Устройство донного фильтра - грунта.
1.6. Практическое руководство по запуску фильтра.
Глава 2 Механическая фильтрация.
2.1. Образование взвеси в замкнутых системах.
2.2. Гравийные (грунтовый) фильтры.
2.3. Песчаные фильтры быстрой очистки воды.
2.5. Практическое руководство.
3.1. Очистка воды активным углем.
3.2. Адсорбция в пеноотделительных колонках (скиммерах).
3.4. Практическое руководство.
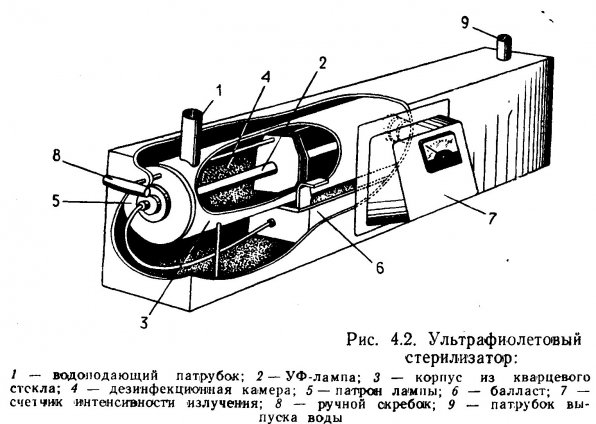
4.1. Ультрафиолетовое облучение аквариума.
4.3. Практическое руководство.
5.3. Практическое руководство.
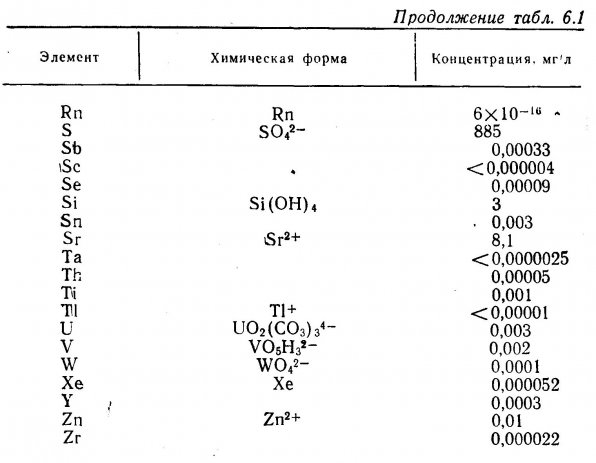
6.1. Солевой состав морской воды.
6.2. Функции элементов и потребность в них.
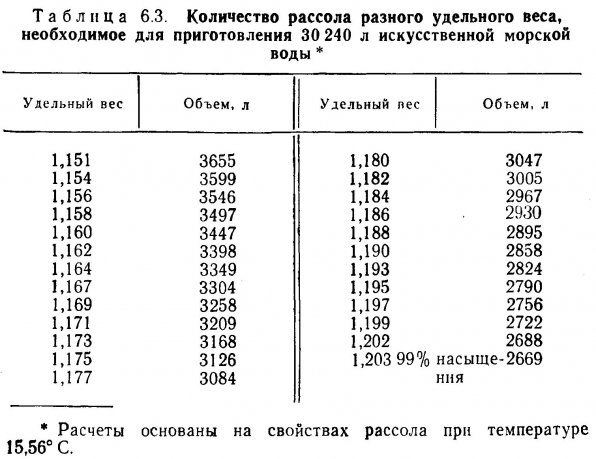
6.3. Искусственная морская вода.
6.4. Практическое руководство.
Глава 7 Буферные системы аквариума.
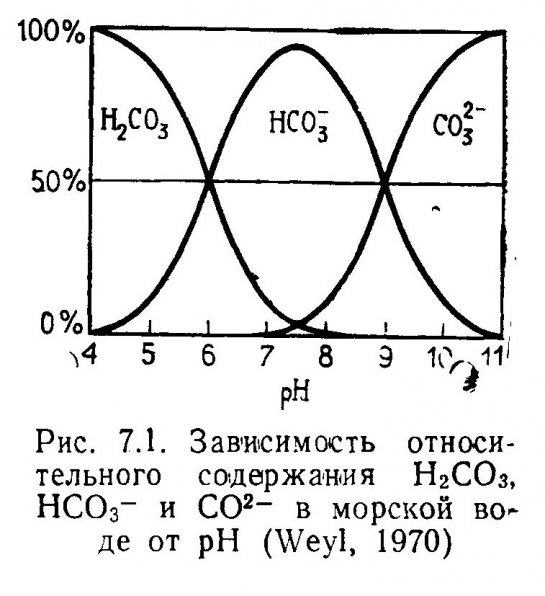
7.1. Карбонатные и бикарбонатные ионы.
7.2. Растворимость минеральных карбонатов.
7.4. Практическое руководство.
Глава 8 Токсичность веществ и профилактика заболеваний.
8.4. Токсичность тяжелых металлов.
8.5. Иммунитет рыб и внешняя среда.
8.6. Профилактика заболеваний.
8.8. Практическое руководство.
В книге описано устройство замкнутых систем для содержания рыбы и беспозвоночных животных. Особое внимание уделено очистке циркулирующей в системах воды биологическим, механическим и физическим методами. Рассмотрено устройство гравийных, песчаных, диатомовых фильтров, ионообменников, ультрафиолетовых облучателей, озонаторов. Описаны процессы газообмена и дыхания рыб в условиях замкнутых систем, профилактика и лечение специфических заболеваний. Изложены способы приготовления больших объемов морской воды и поддержания оптимальных условий среды (буферные системы, pH). Приведен перечень необходимого лабораторного оборудования и приборов, изложены методы гидрохимического анализа воды. По каждому из рассматриваемых вопросов даны практические рекомендации.
Книга предназначена для ихтиологов-рыбоводов, ихтиопатологов, гидрохимиков, студентов рыбохозяйственных вузов и аквариумистов.
Предисловие к русскому изданию.
Предисловие от автора.
Биологическая очистка воды
Биологическая очистка воды включает важнейшие процессы, происходящие в замкнутых аквариумных системах Под биологической очисткой будем понимать минерализацию, нитрификацию и диссимиляцию соединений, содержащих азот, бактериями, обитающими в толще воды, гравий и детрите фильтра. Организмы, выполняющие эти функции, всегда присутствуют в толще фильтра. В процессе минерализации и нитрификации азотосодержащие вещества переходят из одной формы в другую, однако азот остается в воде. Удаление азота из раствора происходит только в процессе денитрификации (см. раздел 1.3).
Биологическая фильтрация является одним из четырех способов очистки воды в аквариумах. Три других способа – механическая фильтрация, физическая адсорбция и дезинфекция воды – рассматриваются ниже.
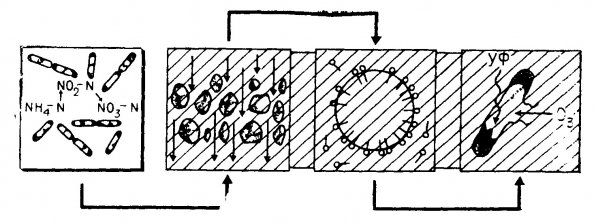
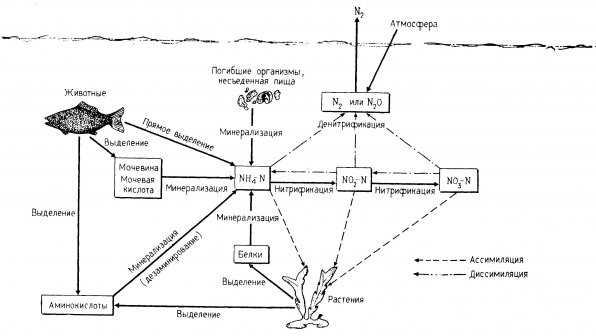
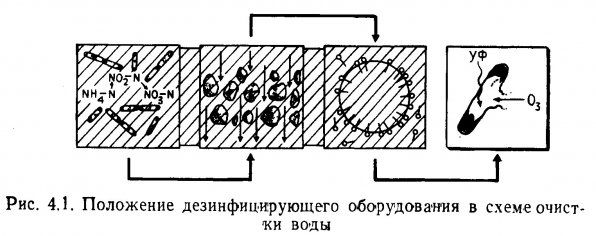
Схема очистки воды показана на рис. 1.1., а круговорот азота в аквариуме, включающий процессы минерализации, нитрификации и денитрификации, - на рис. 1.2.
Рис. 1.1. Место биологической очистки в процессе очистки воды. Слева направо – биологическая очитка, механическая фильтрация, физическое осаждение, дезинфекция.
Рис. 1.2. Круговорот азота в аквариумных замкнутых системах.
Гетеротрофные и автотрофные бактерии – основные группы микроорганизмов, обитающие в аквариумах.
Примечание не из книги автора.
Гетеротрофы (др.греч.— «иной», «различный» и «пища») — организмы, которые не способны синтезировать органические вещества из неорганических путём фотосинтеза или хемосинтеза. Для синтеза необходимых для своей жизнедеятельности органических веществ им требуются экзогенные органические вещества, то есть произведённые другими организмами. В процессе пищеварения пищеварительные ферменты расщепляют полимеры органических веществ на мономеры. В сообществах гетеротрофы — это консументы различных порядков и редуценты. Гетеротрофами являются почти все животные и некоторые растения. По способу получения пищи делятся на две противопоставляемые группы: голозойных (животные) и голофитных или осмотрофных (бактерии, многие протисты, грибы, растения).
Автотрофы (др.греч. - сам + пища) - организмы, синтезирующие органические вещества из неорганических. Автотрофы составляют первый ярус в пищевой пирамиде (первые звенья пищевых цепей). Именно они являются первичными продуцентами органического вещества в биосфере, обеспечивая пищей гетеротрофов. Следует отметить, что иногда резкой границы между автотрофами и гетеротрофами провести не удаётся. Например, одноклеточная водоросль эвглена зелёная на свету является автотрофом, а в темноте — гетеротрофом.
Иногда понятия «автотрофы» и «продуценты», а также «гетеротрофы» и «консументы» ошибочно отождествляют, однако они не всегда совпадают. Например, синезеленые (Cyanea) способны и сами производить органическое вещество с использованием фотосинтеза, и потреблять его в готовом виде, причём разлагая до неорганических веществ. Следовательно, они являются продуцентами и редуцентами одновременно.
Автотрофные организмы для построения своего тела используют неорганические вещества почвы, воды и воздуха. При этом почти всегда источником углерода является углекислый газ. При этом одни из них (фототрофы) получают необходимую энергию от Солнца, другие (хемотрофы) — от химических реакций неорганических соединений.
Гетеротрофные виды утилизируют органические азотосодержащие компоненты выделений водных животных в качестве источника энергии и превращают их в простые соединения, например аммоний (термин «аммоний» относится к сумме ионов аммония (NH4+) и свободного аммиака (NH3), определяемых аналитическим путем, как NH4-N). Минерализация этих органических веществ – первый этап биологической очистки.
Минерализация азотсодержащих органических соединений может начинаться с расщепления белков и нуклеиновых кислот и образования аминокислот и органических азотистых оснований. Дезаминирование – это процесс минерализации, в ходе которого отщепляется аминогруппа с образованием аммония. Предметом дезаминации может служить расщепление мочевины с образованием свободного аммиака (NH3).
Подобная реакция может идти чисто химическим путем, однако дезаминирование аминокислот и сопутствующих им соединений требует участия бактерий.
1.2. Нитрификация воды.
После того как органические соединения переведены гетеротрофными бактериями в неорганическую форму, биологическая отчистка вступает в следующую стадию, получившую название «нитрификация». Под этим процессом понимают биологическое окисление аммония до нитритов (NO2-, определяемых как NO2-N) и нитратов (NO3, определяемых в виде NO3-N). Нитрификация осуществляется главным образом автотрофными бактериями. Автотрофные организмы в отличие от гетеротрофных способны усваивать неорганический углерод (главным образом СО2) для построения клеток своего организма.
Автотрофные нитрифицирующие бактерии в пресноводных, солоноватоводных и морских аквариумах представлены в основном родами Nitrosomonas и Nitrobacter. Nitrosomonas окисляет аммоний до нитритов, а Nitrobacter – нитриты до нитратов.
Обе реакции идут с поглощением энергии. Смысл уравнений (2) и (3) заключается в превращении токсичного аммония в нитраты, которые гораздо менее ядовиты. Эффективность процесса нитрификации зависит от следующих факторов: наличия токсикантов в воде, температуры, содержания растворенного в воде кислорода, солености и площади поверхности фильтра.
Токсичные вещества. При определенных условиях многие химические вещества подавляют нитрификацию. При добавление в воду эти вещества либо подавляют рост и размножение бактерий, либо нарушают внутриклеточный обмен бактерий, лишая их способности к окислению.
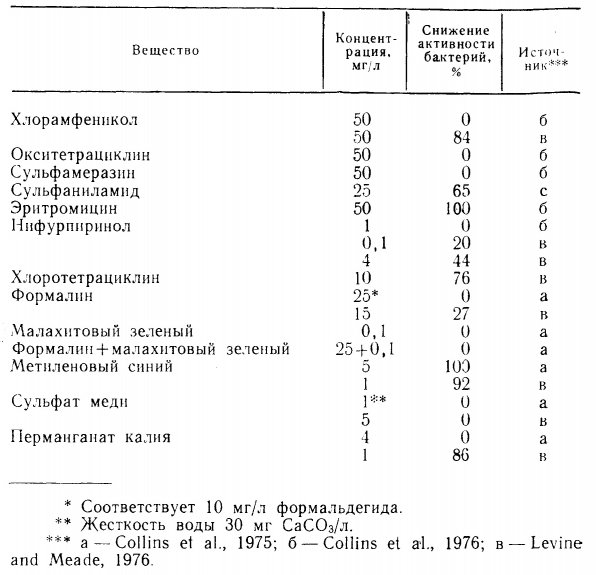
Коллинз с соавторами (Collins et al., 1975, 1976), а также Левайн и Мид (Levine and Meade, 1976) сообщали, что многие антибиотики и другие средства, применяемые для лечения рыб, не влияли на процессы нитрификации в пресноводных аквариумах, в то время как другие оказывались в разной степени токсичными. Параллельные исследования в морской воде не проводились, а приведенные результаты не следует распространять на морские системы.
Приведенные в трех указанных работах данные представлены в табл. 1.1. Результаты исследований не вполне сопоставимы из-за различий в применявшихся методиках.
Таблица 1.1. Влияние терапевтических норм растворенных антибиотиков и лечебных препаратов на нитрификацию в пресноводных аквариумах (Collins et al., 1975, 1976, Levine and Meade, 1976).
Коллинз с соавторами изучал влияние лекарственных препаратов в пробах воды, взятых непосредственно из работающих бассейнов с биофильтрами, где содержалась рыба. Левайн и Мид использовали для опытов чистые бактериальные культуры. Примененные ими методы, по-видимому, отличались более высокой чувствительностью по сравнению с обычными. Так, в их опытах формалин, малахитовый зеленый и нифурпиринол обладали средней токсичностью для нитрифицирующих бактерий, в то время как Коллинз с соавторами показал безвредность тех же препаратов. Левайн и Мид полагали, что расхождения связаны с более высоким содержанием автотрофных бактерий в чистых культурах и порог инактивации был бы выше в присутствии гетеротрофных бактерий и при более высокой концентрации растворенных органических веществ.
Из данных табл. 1.1. видно, что эритромицин, хлоротетрациклин, метиленовый синий и сульфаниламид обладают четко выраженной токсичностью в пресной воде. Наиболее токсичным среди изучавшихся веществ оказался метиленовый синий. Результаты полученные при испытании хлорамфеникола и перманганата калия, противоречивы.
И Коллинз с соавторами и Левайн и Мид сходятся в том, что сульфат меди существенно не подавляет нитрификацию. Возможно, это результат связывания свободных ионов меди с растворенными органическими соединениями. Томлинсон и другие (Tomlinson et al., 1966) обнаружили, что ионы тяжелых металлов (Cr, Cu, Hg) гораздо сильнее воздействуют на Nitrosomonas в чистой культуре, чем в активном иле. Они предположили, что это объясняется образованием химических комплексов между ионами металлов и органическими веществами. Длительное воздействие тяжелых металлов более эффективным, чем кратковременное, по-видимому, из-за того, что адсорбционные связи органических молекул были полностью использованы.
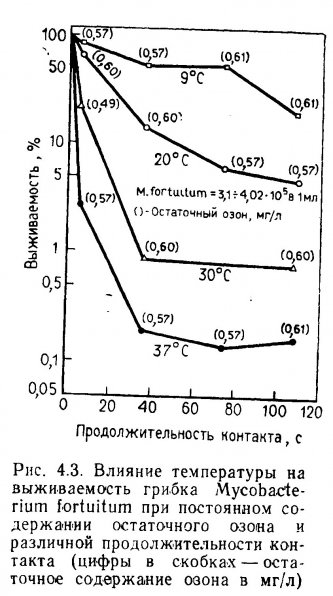
Температура. Многие виды бактерий могут переносить значительные колебания температуры, хотя их активность временно уменьшается. Период адаптации, называемый временной температурной инактивацией (ВТИ), часто проявляется при резких изменениях температуры. Обычно ВТИ заметна при резком охлаждении воды; повышении температуры, как правило, ускоряет биохимические процессы и поэтому период адаптации может остаться незамеченным. Срна и Баггали (Srna and Baggaley, 1975) изучали кинетику нитрификационных процессов в морских аквариумах. Повышение температуры всего на 4 градуса Цельсия приводило к ускорению окисления аммония и нитритов на 50 и 12% соответственно по сравнению с исходным уровнем. При снижении температуры на 1 градус Цельсия скорость окисления аммония уменьшалась на 30%, а при понижении температуры на 1,5 градуса Цельсия скорость окисления нитритов уменьшалась на 8% по сравнению с исходными условиями.
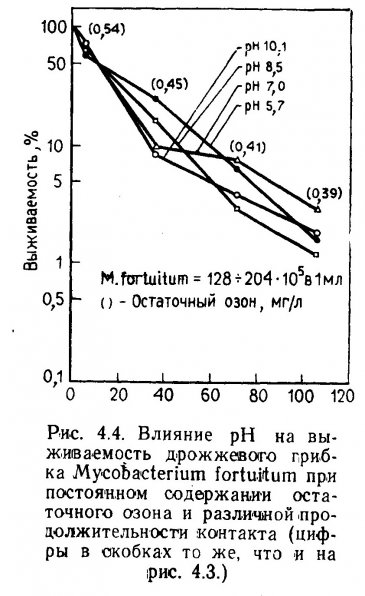
pH воды. Каваи др. (Kawai et al., 1965) обнаружили, что при pH менее 9 нитрификация в морской воде подавляется сильнее, чем в пресной. Они объяснили это пониженным природным pH в пресной воде. По данным Секи (Saeki, 1958), окисление аммония в пресноводных аквариумах при снижении pH подавляется. Оптимальное значение pH для окисления аммония 7,8 для окисления нитритов 7,1. Оптимальным диапазоном pH для процесса нитрификации Секи считал 7,1-7,8. Срна и Баггали показали, что морские бактерии-нитрификаторы были наиболее активны при pH 7,45 (диапазон 7-8,2).
Растворенный в воде кислород. Биологический фильтр можно сравнить с огромным дышащим организмом. При правильной работе он потребляет значительное количество кислорода. Потребности водных организмов в кислороде измеряются в единицах БПК (биологическое потребление кислорода). БПК биологического фильтра частично зависит от нитрификаторов, но в основном оно обусловлено активностью гетеротрофных бактерий. Хараяма (Hirayama, 1965) показал, что при высоком биологическом потреблении кислорода активно действовала многочисленная популяция нитрификаторов. Он пропускал морскую воду через слой песка действующего биологического фильтра. Перед фильтрованием содержание кислорода в воде составляло 6,48мг/л, после прохождения слоя песка толщиной 48см. оно снизилось до 5,26мг/л. В тоже время, содержание аммония снизилось с 238 до 140 мг.экв./л., а нитритов – с 183 до 112 мг.экв./л.
В фильтровальном слое присутствуют как аэробные (для жизни необходим О2), так и анаэробные бактерии (не используют О2), однако в хорошо аэрируемых аквариумах преобладают аэробные формы. В присутствии кислорода рост и активность анаэробных бактерий подавляются, поэтому нормальная циркуляция воды через фильтр сдерживает их развитее. Если содержание кислорода в аквариуме снижается, происходит либо увеличение численности анаэробных бактерий, либо переход от аэробного дыхания к анаэробному. Многие продукты анаэробного обмена токсичны. Минерализация может происходить и при пониженном содержании кислорода, но механизм и конечные продукты в этом случае другие. В анаэробных условиях этот процесс идет скорее как ферментативный, чем как окислительный, с образованием вместо азотистых оснований органических кислот, двуокиси углерода и аммония. Эти вещества наряду с сероводородом, метаном и некоторыми другими соединениями придают задыхающемуся фильтру гнилостный запах.
Соленость. Многие виды бактерий способны обитать в водах, ионный состав которых значительно колеблется, при условии, что изменения солености будут происходить постепенно. ЗоБелл и Миченер (ZoBell and Michener, 1938) обнаружили, что большинство бактерий, выделенных из морской воды в их лаборатории, можно выращивать и в пресноводной воде. Многие бактерии перенесли даже прямую пересадку. Все 12 видов бактерий, считавшихся исключительно «морскими», были успешно переведены в пресноводную воду путем постепенного разбавления морской водой (каждый раз добавляли по 5% пресной воды).
Бактерии биологического фильтра очень устойчивы к колебаниям солености, хотя, если эти изменения значительны и внезапны, активность бактерий подавляется. Срна и Баггали (Srna and Baggaley, 1975) показали, что снижение солености на 8% и повышение на 5% не оказали влияния на скорость нитрификации в морских аквариумах. При нормальной солености воды в морских аквариумных системах нитрифицирующая активность бактерий была максимальной (Kawai et al., 1965). Интенсивность нитрификации уменьшалась как при разбавлении, так и при увеличении концентрации раствора, хотя некоторая активность сохранялась даже после повышения солености воды вдвое. В пресноводных аквариумах активность бактерий была максимальной перед добавлением хлористого натрия. Сразу после того, как соленость сравнялась с соленостью морской воды, нитрификация прекратилась.
Есть данные о том, что соленость влияет на скорость нитрификации и даже на количество конечных продуктов. Кул Манн (Kuhl and Mann, 1962) показали, что нитрификация протекала быстрее в пресноводных аквариумных системах, чем в морских, хотя нитритов и нитратов больше образовалось в последних. Каваи и др. (Kawai et al., 1964) получили сходные результаты, которые представлены на рис. 1.3.
Рис. 1.3. Численность бактерий фильтрационного слоя в малых пресноводных и морских аквариумных системах через 134 дня (Kawai et al., 1964).
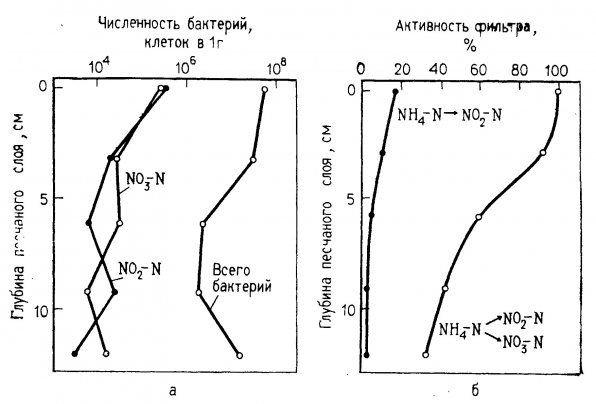
Площадь поверхности фильтра. Каваи и др. обнаружили, что концентрация бактерий нитрификаторов в фильтре в 100 раз выше, чем в протекающей через него воде. Это доказывает важность величины контактной поверхности фильтра для процессов нитрификации, поскольку она обеспечивает возможность прикрепления бактерий. Наибольшую площадь поверхности фильтрующего слоя в аквариумах обеспечивают частицы гравия (грунта), причем процесс нитрификации происходит в основном в верхней части гравийного фильтра, как показано на рис. 1.4. Каваи и др. (1965) определили, что 1 грамме песка из верхнего слоя фильтра в морских аквариумах содержится 10 в 5-й степени бактерий – окислителей аммония 10 в 6-й степени – окислителей нитратов. На глубине всего 5 см. число микроорганизмов обоих типов снижалось на 90%.
Рис. 1.4. Концентрация (а) и активность (б) нитрифицирующих бактерий на разной глубине фильтра в морском аквариуме (Yoshida, 1967).
Форма и размер частиц гравия также важны: мелкие зерна имеют большую поверхность для прикрепления бактерий, чем такое же количество по массе крупного гравия, хотя очень мелкий гравий нежелателен, так как он затрудняет фильтрацию воды. Зависимость между размерами и площадью их поверхности легко продемонстрировать на примерах. Шесть кубиков массой по 1 гр. Имеют в общей сложности 36 единиц поверхности, в то время как один кубик массой 6 гр. Имеет только 6 поверхностей, каждая из которых больше отдельной поверхности малого кубика. Общая площадь шести однограммовых кубиков в 3,3 раза больше площади поверхности одного 6-граммового кубика. По данным Секи (Saeki, 1958), оптимальный размер частиц гравия (грунта) для фильтров это 2-5 мм.
Угловатые частицы имеют большую поверхность, чем округлые. Шар имеет минимальную площадь поверхности на единицу объема по сравнению со всеми остальными геометрическим формами.
Накопление детрита (Термин «детрит» (от лат. detritus — истёртый) имеет несколько значений: 1. Мёртвое органическое вещество, временно исключенное из биологического круговорота элементов питания, которое состоит из останков беспозвоночных животных, выделений и костей позвоночных животных и др.; 2. совокупность мелких неразложенных частиц растительных и животных организмов или их выделений, взвешенных в воде или осевших на дно водоёма) в фильтре обеспечивает дополнительную поверхность и улучшает нитрификацию. Согласно данным Секи 25% нитрификации в аквариумных системах приходится на долю бактерий, населяющих детрит.
Процесс нитрификации приводит к высокой степени окисления неорганического азота. Диссимиляция, «азотное дыхание», или процесс восстановления, развивается в противоположном направлении, возвращая конечные продукты нитрификации к низкой степени окисления. В перерасчете на общую активность окисление неорганического азота значительно превосходит его восстановление, и нитраты накапливаются. Помимо диссимиляции, которая обеспечивает выделение части свободного азота в атмосферу, неорганический азот может быть удален из раствора путем регулярной замены части воды в системе, за счет усвоения высшими растениями или при помощи ионообменных смол. Последний способ удаления свободного азота из раствора применим только в пресноводной воде (см. раздел 3.3).
Диссимиляция – преимущественно анаэробный процесс, который идет в слоях фильтра, испытывающих дефицит кислорода. Бактерии – денитрификаторы, обладающие восстановительной способностью, обычно либо полные (облигатные) анаэробы, либо аэробы, способные переходить на анаэробное дыхание в бескислородной среде. Как правило, это организмы-гетеротрофы, например некоторые виды Pseudomonas, могут восстанавливать ионы нитратов (NO3-) в условиях дефицита кислорода (Painter, 1970).
При анаэробном дыхании бактерии-диссимиляторы усваиваю окись азота (NO3-) вместо кислорода, восстанавливая азот до соединения с низким окислительным числом: нитритов, аммония, двуокиси азота (N20) или свободного азота. Состав конечных продуктов определяется видом бактерий, участвующих в восстановительном процессе. Если неорганический азот восстанавливается полностью, то есть до N2O или N2, процесс диссимиляции называют денитрификацией. В полностью восстановленном виде азот может быть удален из воды и выделен в атмосферу, если его парциальное давление в растворе превышает его парциальное давление в атмосфере. Таким образом, денитрификация в отличие от минерализации и нитрификации снижает уровень неорганического азота в воде.
1.4. «Сбалансированный» аквариум.
«Сбалансированный аквариум» - это такая система в которой активность бактерий, населяющих фильтр, уравновешена с количеством поступающих в раствор органических энергетических веществ. По уровню нитрификации можно судить о «сбалансированности» и пригодности новой аквариумной системы для содержания водных организмов – гидробионтов. Вначале лимитирующим фактором является высокое содержание аммония. Обычно в тепловодных (выше 15 градусов Цельсия) аквариумных системах оно снижается спустя две недели, а в холодноводных (ниже 15-ти градусов) – за более длительный срок. Аквариум может быть готов к приему животных в течении первых двух недель, но он еще не совсем уравновешен, поскольку многие важные группы бактерий еще не стабилизировались. Каваи и др. описали состав популяции бактерий морской аквариумной системы.
1. Аэробные. Их число за 2 недели после посадки рыбы увеличилось в 10 раз. Максимальная численность – 10 в восьмой степени организмов в 1гр. Песка фильтра – отмечена спустя две недели. Спустя три месяца популяция бактерий стабилизировалась на уровне 10 в седьмой степени экземпляров на 1гр. Песка фильтра.
2. Бактерии, разлагающе белок (аммонификаторы).Первоначальная плотность (10 в 3 степени экз./гр) возросла в 100 раз за 4-е недели. Через три месяца популяция стабилизировалась на уровне 10 в 4 степени экз./гр. Столь резкое увеличение численности этого класса бактерий было вызвано внесением корма (свежей рыбы), богатого белком.
3. Бактерии, разлагающие крахмал (углеводы). Начальная численность составляла 10% общего числа бактерий в системе. Затем она постепенно возросла, а через четыре недели начала снижаться. Популяция стабилизировалась спустя три месяца на уровне 1% общей численности бактерий.
4. Бактерии-нитрификаторы. Максимальная численность бактерий, окисляющих нитриты, отмечалась через 4 недели, а «нитратных» форм – через восемь недель. Спустя 2 недели «нитритных» форм было больше, чем «нитратных». Численность стабилизировалась на уровне 10 в 5 степени и 10 в 6 степени экз. соответственно. Существует разница во времени между снижением содержания аммония в воде и окислением в начале нитрификации, обусловленная тем, что рост Nitrobacter падавлен присутствием ионов аммония. Эффективное окисление нитритов возможно лишь после того, большая часть ионов будет преобразована Nitrosomonas. Сходным образом максимум нитритов в растворе должен проявляться до начала накопления нитратов.
Высокое содержание аммония в новой аквариумной системе может быть вызвано нестабильностью численности автотрофных и гетеротрофных бактерий. В начале работы новой системы рост гетеротрофных организмов превышает рост автотрофных форм. Много аммония, образовавшегося в процессе минерализации, усваивается некоторыми гетеротрофами. Другими словами, четко разграничить гетеротрофную и автотрофную переработку аммония невозможно. Активное окисления бактериями-нитрификаторами проявляется только после сокращения и стабилизации численности гетеротрофных бактерий (Quastel and Scholefield, 1951).
Численность бактерий в новом аквариуме имеет значение только до тех пор, пока она не стабилизируется для каждого типа. Впоследствии колебания в поступлении энергетических веществ компенсируются увеличением активности обменных процессов в отдельных клетках без увеличения их общей численности.
В исследованиях Квастела и Шоулфилда (Quastek and Sholefild, 1951) и Срны и Баггалия показано, что плотность популяции нитрифицирующих бактерий, населяющих фильтр определенной площади, относительно постоянна и не зависит от концентрации поступающих энергетических веществ.
Общая окислительная способность бактерий в сбалансированном аквариуме тесно связана с ежедневным поступлением окисляемого субстрата. Внезапное увеличение численности выращиваемых животных, их массы, количества вносимых кормов приводит к заметному возрастанию содержания аммония и нитритов в воде. Такое положение сохраняется до тех пор, пока бактерии не адаптируются к новым условиям.
Продолжительность периода повышенного содержания аммония и нитритов зависит от величины дополнительной нагрузки на перерабатывающую часть водной системы. Если она находится в пределах максимальной производительности биологической системы, равновесие в новых условиях в теплой воде обычно восстанавливается через три дня, а в холодной воде – значительно позднее. Если дополнительная нагрузка превышает возможности системы, содержание аммония и нитритов будет постоянно возрастать.
Минерализация, нитрификация и денитрификация – процессы, протекающие в новом аквариуме более или менее последовательно. В установившейся – стабильной системе они идут почти одновременно. В сбалансированной системе содержание аммония (NH4-N) составляет менее 0,1 мг/л, а все улавливаемы нитриты – результат денитрификации. Упомянутые процессы идут согласованно, без отставания, поскольку все поступающие энергетические вещества быстро усваиваются.
1.5 Устройство донного фильтра - грунта.
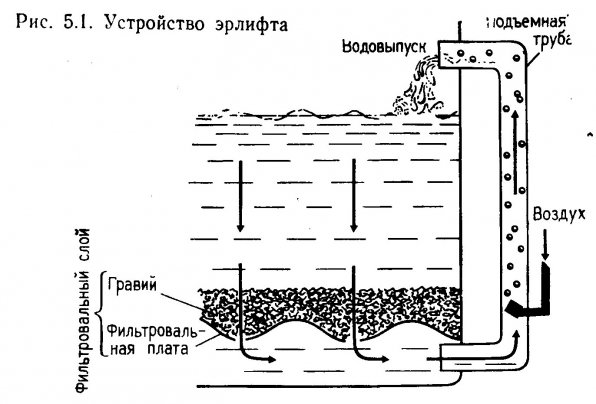
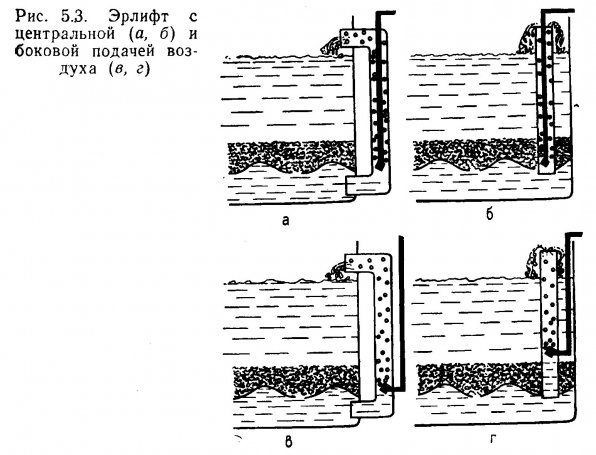
Устройство гравийных (грунтовых) фильтров предшествуют определение общих параметров, подготовка фильтровальной платы и расчет эрлифта. Устройство эрлифтов рассмотрено в разделе 5.1.
Основные требования. Гравийные фильтры полностью обеспечивают биологическую и механическую очистку воды, необходимую для большинства даже очень больших аквариумных систем, поэтому требования к биологической и механической очистке одинаковы и заключаются в следующем: площадь поверхности фильтра должна быть равна площади аквариума, размеры частиц гравия должны составлять 2-5 мм., гравий должен быть отсортирован по размерам частиц, толщина фильтрующего слоя должна быть одинаковой по всей площади фильтра, частицы гравия должны быть неправильной угловатой формы, расход воды должен составлять примерно 0,7*10-3 м/с, минимальная толщина фильтра должна быть 7,6 сантиметров.
Распределение бактерий в фильтрующем слое непосредственно зависит от его толщины, которая косвенно влияет и на эффективность переработки органических веществ в воде. Каваи с соавторами показал, что в морском аквариуме гетеротрофные бактерии были наиболее многочисленны на поверхности фильтрующего слоя, а на глубине 10 см. их число снижалось почти до 90%. Подобная тенденция сохранялась и для автотрофных видов. Популяция бактерий-окислителей аммония и нитритов, плотность которых в поверхностном слое составляла 10 в 5 степени и 10 в 6 степени экз./гр., уменьшалась на 90% на глубине 5 см. Исходя из этого Каваи и др. рекомендовали устраивать неглубокие фильтры с большой поверхностью. Иошида (Yoshida, 1967) сообщал, что в морских аквариумах максимальная активность нитрифицирующих бактерий отмечена в верхних слоях фильтра (см. рис. 1.4). С увеличением толщины слоя активность резко снижалась. Таким образом, требование, чтобы поверхность фильтрующего слоя равнялась площади аквариума, является основным.
Хираями (Hirayama, 1965) показал, что зависимость эффективности переработки органических веществ от толщины фильтра носит непрямой характер в тех случаях, когда критерием служила ОСФ (окислительная способность фильтра). ОСФ можно выразить, как скорость биологического потребления кислорода – БПК/мин. И наоборот, время, необходимое для прохождения воды через фильтр, должно положительно коррелировать с ОСФ. Хираяма показал, что толстые фильтры не имеют преимуществ, так как время, необходимое для прохождения воды через фильтр, пропорционально его толщине. В доказательство этой точки зрения Хираяма поставил эксперимент, в котором отработанная вода проходила через четыре фильтра, различавшихся только по толщине. Время, необходимое для прохождения воды через фильтр, поддерживали постоянным путем измерения расхода воды. В конце опыта оказалось, что ОСФ оставалась одинаковой, несмотря на то, что толщина фильтров была разной. Таким образом, толстые фильтры требуют больших расходов воды, чем тонкие.
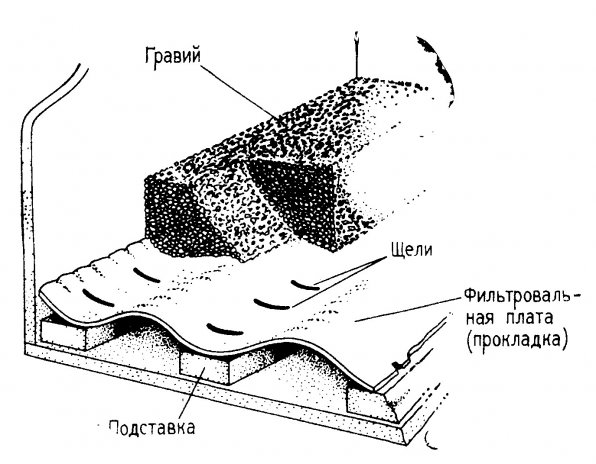
Фильтровальные платы. Фильтровальная плата отделяет фильтрующие слои от дна аквариума. Примечание: в современной аквариумистике такое обустройство донного фильтра называют – фальшдно. В аквариумистике фальшдно применяется редко. Важно плотно склеить края платы со стеклами аквариума, чтобы под нее не просыпался гравий (грунт). Для большинства аквариумов фильтровальная плата может быть изготовлена из любого пористого материала, не подвергающегося коррозии в воде. В аквариумах «Ниагара-Фолс» и «Мистик МаринЛайф» применены гофрированные листы из армированного стекловолокна и сетка их эпоксидной смолы и армированного стекловолокна. В гофрированных листах с помощью настолькой циркулярной пилы, оборудованной фрезой для резьбы по пластмассе, следует прорезать щели перпендикулярно ребрам жесткости. Ширина щели (рис. 1.6.) 1 мм, длина 2,5 см., расстояние между щелями пять сантиметров. После этого панели укладывают прорезями вниз аквариум и заделывают стыки с помощью ленты из стекловолокна (ширина 5 см) и силиконового клея. После того, как клей полностью затвердеет, можно наспать слой гравия (грунта) и разровнять его по плате.
При использовании сетки ее разрезают сверху пластиковым ситом и закрепляют его на сетке с помощью лески или стальной нержавеющей проволоки. Затем стыки герметизируют силиконовым клеем. И листы и сетки должны быть отделены от дна аквариума специальными подставками, например из бетона, или половинками полихлорвиниловых труб требуемой длины, разрезанных вдоль и установленных на рая.
Рис. 1.6. Поперечный разрез аквариума, показывающий устройство фильтрованной платы из гофрированного стеклопластика.
Важно, чтобы вода могла свободно циркулировать между прокладками. Бетонные подставки покрывают тремя слоями эпоксидного клея, особенно в морских аквариумах, для предохранения бетона от эрозии. Подставки не следует прикреплять ни к фильтровальной плате, ни к дну аквариума.
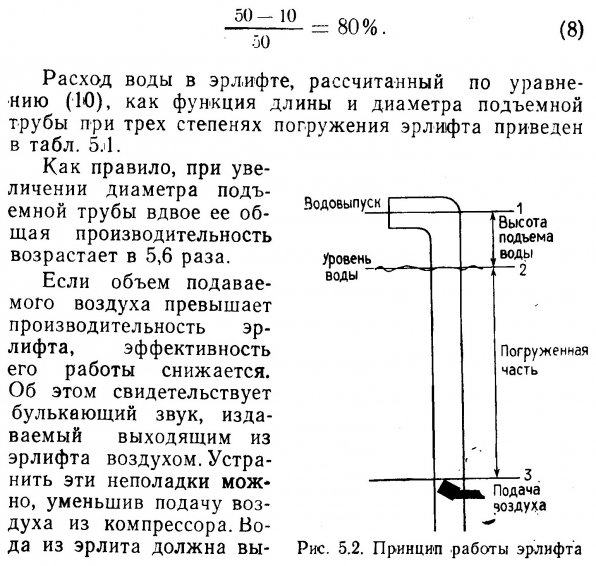
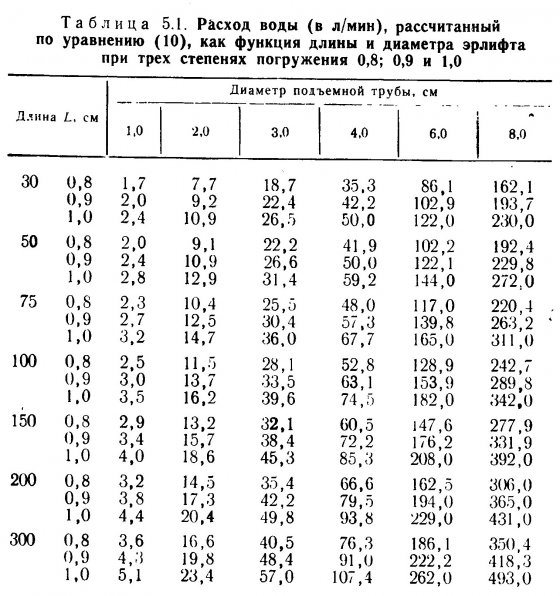
Производительность фильтра. Важным аспектом биологической очистки является производительность фильтра, которую определяют по максимальному количеству животных, способных жить в данной аквариумной системе. Хираяма предположил следующую формулу для расчета производительности фильтра в морских аквариумах (Уравнение пригодно и для пресноводных аквариумов, однако нуждается в уточнении).
Левая часть уравнения описывает окислительную способность фильтра (ОСФ), выраженную количеством О2 (в мг), потребляемых в минуту.
Правая часть уравнения (4) характеризует скорость «загрязнения» воды животными. Она также выражается количеством О2 (в мг), потребляемых в минуту.
Как видно из формулы (4), окислительная способность фильтра может быть больше или равна скорости «загрязнения» воды животными. Важно также отметить, что чем меньше масса отдельных животных, тем ниже производительность аквариумной системы. Другими словами, производительность биологического фильтра не является простой функцией массы животных.
Система которая может обеспечит жизнедеятельность одной рыбы массой 100гр., может не выдержать нагрузку от 10 рыб массой по 10гр. Предположим, в гипотетическом аквариуме W=0,36м2, V=10,5 см/мин, D=36 см. Если грунт однороден по размеру и R=4мм, то из уравнения (5) следует, что G=(1/4)*100=25. Подставив эти данные в левую часть уравнения (4), получим окислительную способность фильтра (ОСФ), которая эквивалента скорости биологического потребления кислорода – БПК/мин.
Предположим далее, что в аквариуме содержаться рыбы массой 200гр. И их суточный рацион составляет 5% массы тела. Из правой части уравнения (4) (ОСФ обозначена Х) следует, что:
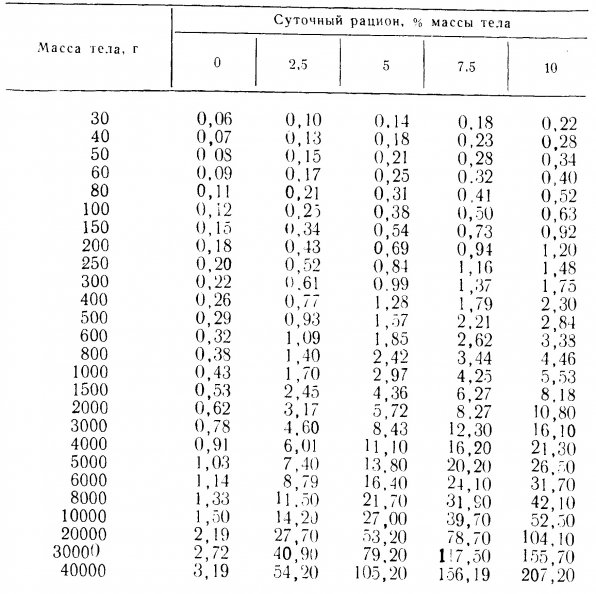
В таблице 1.2 приведены значения Х для одной рыбы в зависимости от ее массы (в гр.) и величины суточного рациона (в % массы тела). Из табл. 1.2. следует, что одна рыба массой 200гр., суточный рацион которой составляет 5% массы ее тела, создает «нагрузку» на фильтр, равную 0,69 ОСФ/мин. При этом q=Х/0,69=3,2/0,69=4,6 рыбы, то есть в аквариуме можно содержать четырех рыб.
Таблица 1.2. Нагрузка на фильтр в зависимости от массы одной рыбы и величины суточного рациона (в % массы тела).
Применять эту методику следует с осторожностью. Нагрузка на фильтр изменяется по мере роста животных, а его производительность может внезапно превышена из-за гибели рыбы или при резком снижении содержания кислорода.
В качестве еще одного примера определим, можно ли в аквариуме из первого примера содержать 10 рыб по 50 гр. и одну массой 600гр. при той же норме кормления – 5% массы тела ежесуточно. Как видно из табл. 1.2., нагрузка на фильтр составит 10(0,21)+1(1,85)=3,95 ОСФ/мин. Ответ будет отрицательным, поскольку нагрузка на фильтр превышает его производительность, которая составляет 3,2 ОСФ/мин.
1.6. Практическое руководство по запуску фильтра
Правильная эксплуатация биологического фильтра включает меры по запуску нового фильтра и обеспечение надлежащего ухода за действующим фильтром.
Запуск нового аквариума. Во время запуска нового фильтра лучше всего дать на него повышенную нагрузку, то есть адаптировать его к несколько повышенной нарузке по числу животных. Такой запас производительности фильтра предотвратит в дальнейшем повышение содержания аммония и нитритов при подсадке в аквариум новых животных.
Для ввода в действие нового аквариума следует использовать только неприхотливых животных. Животных, чувствительных к аммонию, можно выпускать в аквариум только после завершения процессов нитрификации. Лучше всего сначала запустить черепах. Они гораздо менее чувствительны к аммонию, чем рыбы и многие беспозвоночные, кроме того, черепахи выделяют достаточное количество органических веществ для начала процессов минерализации и нитрификации.
Примечание: в наших современных домашних аквариумах первыми рекомендуется высаживать улиток, растения, панцирных сомиков - коридорасов, лорикариевы сомиков - анциструсов. Это достаточно стойкие первопроходцы и стоят не так дорого.
Неплохим методом запуска фильтра является постепенное увеличение количества животных в аквариуме. Если неприхотливых животных нет, а виды, предназначены для выращивания, чувствительны к аммонию, число животных следует доводить до максимального постепенно. Например, если содержание аммония необходимо постоянно поддерживать на уровне 0,2 NH4-N/л, численность животных следует увеличивать медленно, постепенно доводя содержания аммония до требуемого уровня, подсаживая новых особей не ранее, чем бактерии нитрификаторы доведут содержание аммония до 0,2 мг/л или ниже. Эта методика весьма трудоемка. Первый сопосб – создание резервной производительности фильтра при помощи неприхотливых животных – быстрее и практичнее.
В холодной воде рост бактерий и их адаптация замедленны. Процессы биологической очистки могут быть ускорены, если до стабилизации процессов нитрификации подогревать воду и содержать аквариуме теплолюбивые виды. Затем тепловодных животных можно удалить, температуру воды понизить, а в аквариум столько же (а лучше меньшее) по массе холодноводных животных. Иногда после посадки холодноводных животных отмечается слабое увеличение содержания в воде аммония и нитритов, даже если аквариум был предварительно «сбалансированным». Если разность температур не слишком велика, то концентрация аммония через несколько дней выровняется, что свидетельствует об адаптации бактерий к холоду. Увеличение содержании аммония можно свести к минимуму, если дать бактериям время для адаптации к пониженной температуре (96ч.), а уже после этого помещать в аквариум холодноводных животных.
Хорошим методом, позволяющим ускорить «запуск» нового фильтра, является перенесение в новый аквариум сформировавшейся популяции бактерий из действующего фильтра (выжимка из фильтра). В новый аквариум могут быть добавлен грунт и детрит из сбалансированного аквариума. Грунт следует брать из аквариума, где температура в течение нескольких недель была такой же, как и в новом аквариуме.
Смена воды в аквариуме. Избыток детрита нежелателен, так как он затрудняет протекание воды через фильтр. По мере накопления детрита в фильтре образуются вертикальные каналы, по которым вода протекает с наименьшим сопротивлением, обходя большую часть фильтровального слоя. В результате в фильтре начинается кислородное голодание, образуются бескислородные зоны, где подавляется рост аэробных бактерий. По этой же причине нежелательно использование очень мелкого песка, особенно толстых фильтрах («жирный» слой грунта).
Удаление избыточного детрита осуществляется путем промывки верхнего слоя и переводом детрита во взвесь. Затем он может быть удален сифоном одновременно с заменой 10% старой воды. Промывать грунт следует аккуратно. Каваи и др. отбирал 1 гр. песка с поверхности фильтра и промывали чистой морской водой. После этого нитрифицирующая способность снижалась на 40%. При повторной промывке она снижалась еще больше. При интенсивной промывке другого образца нитрифицирующая способность снизилась на 66%, последующей промывке – еще на 14%. Эти опыты показали, что значительная часть бактерий-нитрификаторв населяет детрит и при интенсивной промывке бактерии удаляются с поверхности фильтра. Фильтрующий слой – постоянная система. Грунт нельзя извлекать и промывать, так как при этом вместе с детритом удаляются и микроорганизмы. В тех случаях, когда промывка фильтра совершенно необходима, делать это следует непосредственно в аквариуме, используя чистую воду той же солености. В пресноводных аквариумах – соответственно отстоенную водопроводную воду.
На процессы нитрификации отрицательное влияние оказывают колебания температуры, pH, содержания растворенного кислорода и солености. Среди этих факторов наиболее существенными являются изменение температуры и солености. Менее важны колебания pH и содержание растворенного кислорода.
Необходимо иметь в виду, что растения и животные, которых обычно содержат в аквариумах, гораздо чувствительнее к изменениям физико-химических характеристик воды, чем бактерии. В связи с этим в первую очередь следует учитывать потребности менее устойчивых высших организмов и лишь затем бактерий, населяющих фильтр, отдельные клетки которых способны выживать в самых плохих условиях. Таким образом, приведенные здесь диапазоны параметров среды хотя и являются узкими для бактерий, но не препятствуют нормальному развитию остальных гидробионтов.
Отклонения параметров внешней среды следует регистрировать ежедневно, а также перед сменой части воды или пополнении испарившейся воды. Содержание кислорода должно быть на уровне 100% насыщения, это относится и к добавляемой воде. Это необходимо главам образом для содержащихся животных, так как нитрифицирующие бактерии не слишком требовательны к содержанию кислорода. Допустимый уровень колебаний pH в солоноватой и морской воде 8-8,3, в пресноводной – 7,1-7,8; pH добавляемой воды должен быть близок к pH в аквариуме.
Температура воды оказывает наиболее заметное влияние на процессы нитрификации, а возможно, и минерализации. При снижении температуры воды можно заметить отчетливую задержку в превращениях биогенных веществ. Повышение температуры обычно увеличивает активность бактерий. Большинство холоднокровных животных плохо переносят даже небольшие температурные колебания, если они происходят очень быстро. Колебания температуры при замене части воды в аквариуме не должны превышать 1 градуса Цельсия в сутки. Это означает, что добавляемую воду необходимо предварительно подогревать или охлаждать. Если аквариум эксплуатируется при комнатной температуре, воду для замены следует держать в той же комнате в закрытом сосуде и не использовать до тех пор, пока ее темература не сравняется с температурой воды в аквариуме.
Морская водя, предназначенная для замены, должна быть соответствующей солености. Разбавлять морскую воду для солоноватоводных аквариумов следует в отдельном сосуде, свежую воду добавлять небольшими порциями, делая перерывы, чтобы обитатели аквариума могли к ней адаптироваться. Приготовление воды требуемой солености в отдельном сосуде сводит к минимуму возможные ошибки и не нарушает установившуюся в аквариуме соленость. Более того, разбавление морской воды уменьшает возможность колебания солености в ранее приготовленной воде.
Для восполнения потерь от испарения в аквариумах с любой соленостью и замены части воды в пресноводных аквариумах рекомендуется отстоянную водопроводную воду, то есть воду, которую в течении трех дней держали в открытом сосуде для удаления хлора. В солоноватоводных и морских аквариумах испарение воды с поверхности ведет к увеличению солености, которое обычно не оказывает заметного влияния на большинство организмов, так как происходит постепенно. Однако не следует допускать значительного повышения солености к моменту пополнения аквариума свежей водой. Солоноватоводные и морские аквариумы необходимо закрывать для уменьшения испарения воды с поверхности и добавлять пресную воду уже при увеличении солености на 0,2%.
Механическая фильтрация
Механическую фильтрацию применяют для уменьшения мутности воды в аквариуме. Мутность может увеличиваться в результате периодических «вспышек» развития водорослей или бактерий, но обычно она – следствие образования в воде взвесей. Взвеси различаются по размеру образующихся частиц и их происхождению. Мельчайшие частицы, образующие взвеси, слипаясь, превращаются в скопления – агрегаты, которые, склеиваясь, в свою очередь формируют детрит. Детрит – это хорошо заметный коричневый налет, который обычно образуется на поверхности старых фильтров. В состав детрита входят органические и неорганические компоненты, на которых позже поселяются живые микроорганизмы. В данной книге частицы, агрегаты, детрит, свободно плавающие водоросли и бактерии все вместе называются взвешенным органическим веществом (ВОВ), за исключением особо оговоренных случаев.
При механической фильтрации ВОВ улавливается специальным субстратом или сетками. В схеме очистки воды механическая фильтрация следует за биологической очисткой, но предшествует физической адсорбции и дезинфекции. Биологическая и механическая очистка происходят на гравийных (грунтовых) фильтрах одновременно, и требования, предъявляемые к обоим процессам, одинаковы.
2.1. Образование взвеси в замкнутых системах.
Бейлор с соавторами (Baylor et al., 1962) и Сатклифф и др. (Sutcliffe et al., 1963) показали, что морской воде частицы могут образовываться путем адсорбции на поверхности воздушных пузырьков растворенного органического вещества (РОВ). Баусинг и др. (Batoosingh et al., 1969) обнаружили, что «затравкой» при образовании агрегатов во время барботации могут служить мелкие частицы размером от 0,22 до 1,2 мкм. Они также показали, что любые частицы (живые и неживые) интенсифицируют образование агрегатов, и опровергли мнение Барбера о том, что для нормального течения процесса необходимо присутствие живых бактерий.
Баустинг обнаружил, что мелкие пузырьки воздуха более благоприятны для образования агрегатов, чем крупные. Это можно объяснить большей контактной поверхностью мелких пузырьков для адсорбции поверхностно-активного материала из раствора. Шелдон и др. (Sheldon et al., 1967) показали, что количество формирующихся частиц в фильтруемой морской воде может быть увеличено путем увеличения концентрации РОВ. Удвоение ее (до 4 мг С/л) путем добавления глицина вызывало десятикратное увеличение количества частиц.
Баустинг отметил, что в тех случаях, когда продолжительность аэрации в экспериментах варьировалась, в начале образовывалось много агрегатов, а затем меньше, так что в ходе 24-часового эксперимента агрегатов образовалось всего в 2 раза больше, чем при 3-6 часовом. Присутствие в воде естественных или искусственных частиц, по-видимому, тормозит дальнейшее образование агрегатов. Постоянная фильтрация по сравнению с периодической способствует образованию большего количества агрегатов в аквариумах. Таким образом, для образования в процессе аэрации взвесей в воде должны присутствовать инициирующие частицы, однако когда их слишком много, процесс тормозится.
Формирование агрегатов и детрита происходи, по-видимому, сходным образом. Процесс локализуется в двух местах: внутри эрлифтов и на границе воздушной сферы, то есть на поверхности воды у выхода из эрлифтов. Возможно взвеси и детрит образуются на поверхности поднимающихся воздушных пузырьков в аэарлифтах так же, как и в морской воде, где на пузырьках воздуха адсорбируются растворенные поверхностно-активные органические соединения. На поверхности воды пузырьки воздуха превращаются в мономолекулярную пленку, способную адсорбировать другие вещества. Если это предположение верно, то процесс образования взвесей и детрита в аквариумах с умеренным содержанием растворенного органического вещества (РОВ) может быть интенсифицирован пропусканием более мелких пузырьков, увеличением интенсивности барботации (пропускания воздуха (газа) через жидкость), постоянным удалением образующихся частиц путем механической фильтрации. Фильтрация позволяет отводить избыток частиц, которые замедляют процесс дальнейшего детритообразования.
Представляется, что ускорение процесса образования взвесей и детрита является действенным средством, коственно снижающим содержание РОВ в воде. Естественно этот процесс должен быть дополнен отфильтровыванием детрита вместе с РОВ, адсорбированным при его формировании.
2.2. Гравийные (грунтовый) фильтры.
Гравийные фильтры удаляют взвешенное органическое вещество из протекающей воды, задерживая его на поверхности гравия либо в промежутках между гравийными зернами.
Мнения специалистов о том, каким образом ВОВ удаляются и воды фильтрующим слоем, расходятся. Ясно, что здесь происходят и отцеживание, и осаждение, и диффузия, и химическое взаимодействие между поверхностью фильтрующего материала и ВОВ. Эффективность удаления ВОВиз протекающей воды зависит главным образом от трех факторов: размеров зерна и равномерности распределении гравия, формы зерен и гравия и наличия детрита.
Размеры гравия и распределение слоев. Эффективность механической фильтрации возрастает по мере уменьшения размеров зерен гравия. Мелкие зерна имеют большую поверхность осаждения ВОВ. Более того, узкие промежутки между зернами гравия обеспечивают удаление мельчайших частиц взвеси, в результате чего на единицу объема отфильтрованной воды приходится больше осажденного материала. В биологических фильтрах с эрлифтами, не оборудованных системой обратной промывки, применяют гравий одного размера. При смешивании гравия разного размера общая фильтрующая поверхность уменьшается. На участках фильтра, где преобладают крупные фракции гравия, образуются большие пустоты. В этих местах детрит может проникать на большую глубину, затрудняя промывку фильтра.
Путь, который вода проходит в своем движении через фильтр, обусловлен распределением зон с наименьшим сопротивлением. Если гравий размещен по фильтровальной плате неравномерно, ток воды искривляется. Тонкие участки фильтра оказывают напору воды меньшее сопротивление, чем толстые, поэтому основной объем фильтруемой воды проходит через них. Это ведет к постоянной мутности воды в аквариумах с фильтрами из не рассортированного по размерам гравия.
Форма гравийных зерен. Неровный угловатый гравий более всего подходит для механической очистки воды. Большая поверхность такого гравия способствует осаждению взвеси и накоплению детрита.
Роль детрита. Накопление в фильтре определенного количества детрита повышает эфективность механической очистки воды. Детрит заполняет промежутки между отдельными зернами гравия, в результате чего фильтр улавливает более мелкие частицы взвеси. Старые фильтры обычно лучше очищают воду, чем новые, так как содержат больше детрита.
2.3. Песчаные фильтры быстрой очистки воды
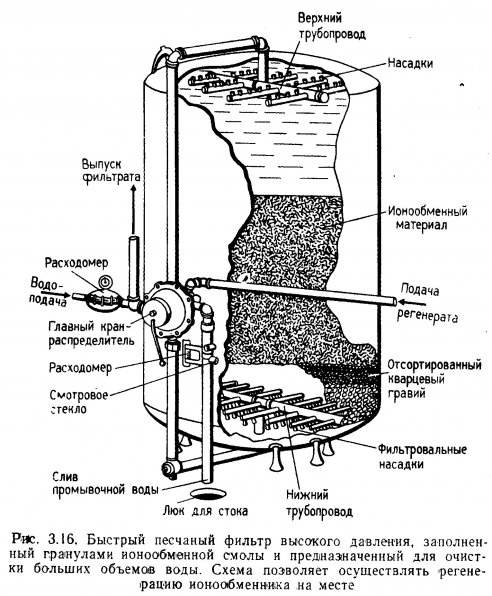
Быстрые песчаные фильтры применяют в демонстрационных аквариумах, в инкубаторных цехах рыбоводных заводов и в хозяйствах аквакультуры, когда необходимо очищать большие объемы воды. Предварительная очистка воды на таких фильтрах устраняет мутность воды и многие болезнетворные организмы. Фильтры такого типа применяются в некоторых системах оборотного водоснабжения, особенно при высокой биологической нагрузке. В быстрых песчаных фильтрах вместо эрлифтов применяются насосы, поскольку расход воды в них в несколько раз выше, чем в гравийных. По степени очистки воды они не имеют преимуществ перед правильно отрегулированными гравийными фильтрами, однако больший расход воды и применение более мелкого фильтрующего материала позволяют быстрее удалять мутность.
По конструкции и обслуживанию быстрые песчаные фильтры отличаются от гравийных, хотя механизмы удаления ВОВ (отцеживание, осаждение и т.д.) идентичны. Площадь адсорбционной поверхности не имеет решающего значения из-за высокого расхода воды. Более того, удаление ВОВ происходит не только на поверхности, но и в толще фильтра.
В быстрых песчаных фильтрах слой мелкого песка обычно укладывают поверх одного или нескольких слоев отсортированного кварцевого гравия. Размер зерен гравия в слоях возрастает сверху вниз. В некоторых конструкциях в качестве поверхностного фильтрующего материала используют слой антрацита, укладывая его на подушку из песка и трех слоев кварцевого гравия с увеличивающимися по размеру зернами. Сочетание антрацита с гравием обозначают как «двойнун среду». Антрацитовая крошка крупнее песчинок, что позволяет частицам взвесей разной величины проникать в фильтровальный слой. Такой заполнитель способствует увеличению площади адсорбционной поверхности и удлинению интервалов между промывками фильтра.
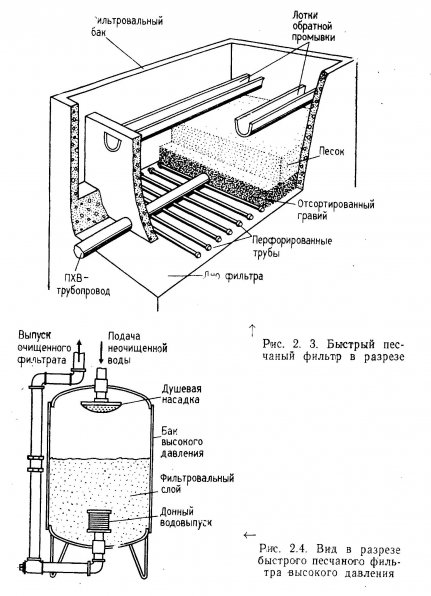
Песчаные фильтры открытого типа. Открытые песчаные фильтры предназначены для быстрой очистки воды и устанавливаются в открытых бассейнах (рис. 2.3). Они изготовляются в основном из бетона и отличаются большими, размерами. Циркуляция воды достигается путем откачивания ее, из-под фильтра. У дна бассейна создается частичный вакуум, и под действием атмосферного давления ток воды через фильтр усиливается. Принципы циркуляции воды те же, что и в гравийных фильтрах, с той лишь разницей, что в песчаных фильтрах применяют механические насосы и расход воды в связи с этим значительно больше. Такие фильтры обычно используются для очистки питьевой воды и бытовых стоков. Большинство конструкций фильтров, описанных в технической литературе, может быть приспособлено для очистки воды в больших аквариумах.
Быстрые песчаные фильтры высокого давления. Направление тока воды в таких фильтрах показано на рис. 2.4. Вода попадает в закрытую камеру высокого давления через душевую насадку, расположенную в ее верхней части. Затем она проходит вниз под давлением через слой фильтрующего материала. Быстрые песчаные фильтры высокого давления выпускаются нескольких типоразмеров, изготовляются в основном из стали.
Фильтры из армированного стекловолокна типа выпускаемых фирмой «Джакузи Брос» наиболее пригодны для очистки морской воды, так как не, имеют корродирующих частей. На рис. 2.5 представлена модель, которую можно установить на аквариуме средней вместимости (примерно 4000 л).
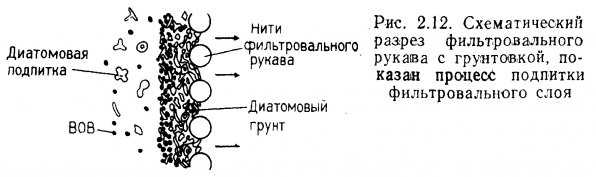
В диатомовых фильтрах слой отсортированных, известковых створок микроскопических диатомовых водорослей, удерживаемый на поверхности пористого рукава давлением воды, обеспечивает извлечение из воды взвешенного органического вещества (ВОВ). По сравнению с гравийными и песчаными фильтрами диатомовые фильтры способны улавливать более мелкие частицы взвеси. Самые тонкие фракции диатомового наполнителя способны улавливать частицы размером менее 0,1 мкм.
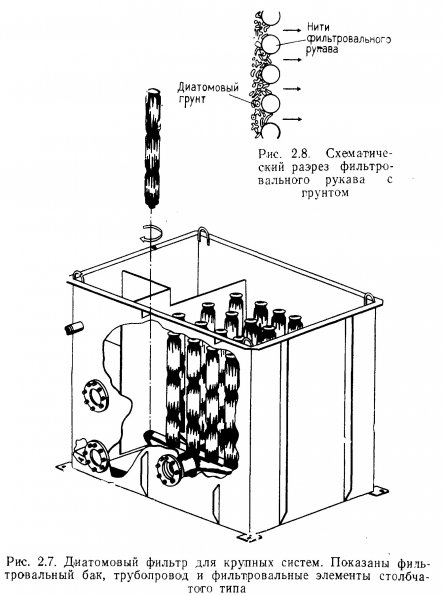
Фильтрующее устройство диатомового фильтра состоит, из двух частей: пористого сердечника и фильтровального рукава. Тонкий, плотный, эластичный, сотканный из полипропиленовых нитей, рукав натягивается на сердечник. Другие материалы, например нейлон, менее прочны. В крупных фильтрах рукава делают съемными. Сердечник вместе с рукавом составляет фильтрующий элемент. На рукав наносится диатомовый грунт, а сердечник поддерживает его в расправленном состоянии и способствует нормальной циркуляции воды.
На рис. 2.6 показан узел очистки с фильтрующими элементами пластинчатого типа и водопроводной сетью. Сердечники не видны, так как они закрыты рукавами. Фильтр с элементами столбчатого типа и трубопроводом представлен на рис. 2.7.
Слой диатомового грунта препятствует засорению рукава частицами взвеси и уменьшению его пористости. Этот так называемый фильтровальный «пирог» и осуществляет собственно фильтрацию (рис. 2.8). Вода, проходя через фильтр, оставляет на нем частицы взвеси.
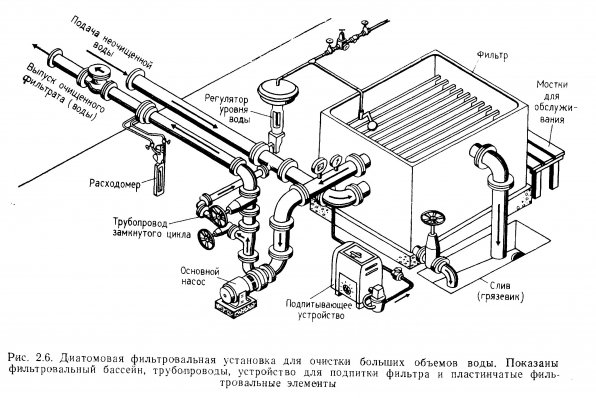
Диатомовые фильтры открытого типа. Конструкции типичных диатомовых фильтров открытого типа показаны на рис. 2.6 и 2.7. Очистка происходит в открытом бассейне или его отсеке. Вода подается в бассейн, проходит через фильтровальные элементы в трубопровод и затем поступает к насосу. Принцип движения воды тот же, что и в открытом гравийном фильтре. Все открытые диатомовые фильтры предназначены для очистки больших объемов воды.
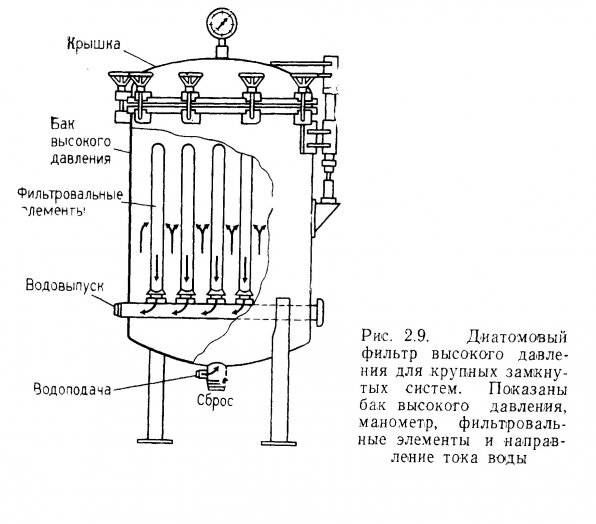
Диатомовые фильтры высокого давления. Диатомовый фильтр высокого давления, предназначенный для очистки больших объемов воды, показан на рис. 2.9. Фильтровальные элементы помещены внутри герметичной камеры. Вода с взвесями продавливается через фильтровальные элементы, частицы оседают на диатомовом грунте, а очищенная вода снова подается в аквариум. По принципу работы эти фильтры не отличаются от песчаных фильтров высокого давления.
Диатомовые фильтры высокого давления выпускаются нескольких типоразмеров, в том числе специальные устройства для небольших по объему аквариумов (рис. 2.10). Это оборудование, одинаково пригодное для соленой и пресной воды, поставляет фирма «Вортекс Иннерспейс Продактс». Эффективность работы диатомовых фильтров (как открытых, так и высокого давления) зависит главным образом or трех факторов: площади поверхности фильтровальных элементов, целостности диалогового грунта и своевременной «подпитки» фильтровального «пирога».
Площадь поверхности. Важно правильно определить оптимальную площадь фильтровальных элементов, особенно если фильтр предназначен для полного удаления всех взвесей, образующихся в системе. Маломощный фильтр требует частых промывок, что трудоемко и дорого, поскольку диатомовый наполнитель при этом теряется.
Грунтовка фильтра. После промывки фильтр покрывают новым слоем диатомового грунта (см. рис. 2.8). Предварительно старый слой диатомового фильтрующего материала вместе с накопившимся детритом смывают. Слой нового фильтрата предназначен для защиты пористого рукава от заиления органическим материалом. Перед началом грунтовки фильтр должен быть отключен от аквариума и функционировать как самостоятельная замкнутая система. Это достигается установкой специального вентиля.
Для проведения грунтовки в воду добавляют диатомовый порошок и систему эксплуатируют в замкнутом режиме до тех пор, пока он полностью не осядет на фильтровальных элементах. После добавления диатомового порошка вода приобретает молочный цвет. Когда она полностью осветлится, грунтовку можно считать законченной. Для проведения грунтовки используют только чистую воду без органических взвесей, содержащихся в аквариумной воде. Затем фильтр подключают к аквариуму и он начинает работать в общей циркуляционной системе.
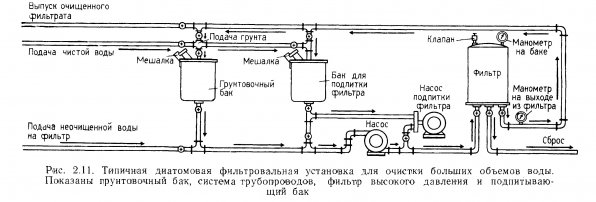
Для грунтовки открытых фильтров специального оборудования не требуется. Диатомовый порошок просто рассыпают по поверхности воды в фильтре, работающем в замкнутом режиме. Постоянно работающий фильтр высокого давления гpунтуют при помощи специального смесительного бака. Необходимое количество сухого диатомового порошка разводят в воде до образования суспензии, которую затем подают в бак-смеситель, откуда она по трубам поступает в бак высокого давления и на фильтровальные элементы (рис. 2.11). На 1 кв.м поверхности фильтровального рукава требуется 1 кг сухого диатомового порошка.
Водопроводная сеть во всех диатомовых фильтрах должна быть сконструирована так, чтобы после грунтовки перед началом фильтрации напор воды в фильтре не ослабевал. Диатомовые частицы удерживаются на рукаве за счет небольшого вакуума в сердечнике и повышенного давления воды на фильтровальный слой. В случае остановки насосов слой грунтовки начинает осыпаться.
Подпитка слоя грунта. Пористость фильтрующего слоя не остается постоянной, так как его поверхность покрывается частицами отфильтрованной взвеси. В непрерывно действующих системах пористость фильтра поддерживается путем добавления на наружную поверхность фильтровального слоя, небольшого количества диатомового порошка с помощью дозирующего насоса. Эти незначительные добавки и подпитывают слой грунта (рис. 2.12). Без подпитки интервалы между промывками фильтра заметно укорачиваются. Оптимальное количество добавок находят методом проб и ошибок, однако вначале требуется примерно 0,5 кг сухого диатомового порошка на 1 кв.м. поверхности фильтра.
2.5. Практическое руководство.
И диатомовые, и быстрые песчаные фильтры необходимо периодически очищать путем обратной промывки. Быстрые песчаные фильтры, кроме того, можно использовать для удаления избыточного количества детрита с гравийных фильтров. Диатомовые фильтры нуждаются в более тщательном уходе, чем быстрые песчаные, хотя выбор фильтра диктуется конкретными условиями и стоимостью.
Очистка быстрых песчаных фильтров. Быстрые песчаные фильтры очищают обратной промывкой, т. е. меняют направление тока воды через фильтр на противоположное. По мере подъема воды зерна гравия всплывают, весь фильтр как бы разбухает. Детрит, который легче верхнего слоя фильтранта, всплывает первым и выносится током воды в отходы.
Зерна гравия находятся во взвешенном состоянии лишь мгновение, когда действующая на них сила тока воды и сила тяжести примерно равны между собой. После промывки фильтрант оседает, причем слои фильтрующего материала располагаются в первоначальном порядке (некоторое перемешивание происходит лишь на границе слоев). Извлеченный в результате промывки детрит удаляется тремя способами. Во-первых, свободный детрит просто подхватывается с поверхности фильтра током воды и уносится в сливное отверстие. Во-вторых, детрит из глубины фильтра и материал, слабо прикрепленный к фильтранту, удаляются непосредственным напором воды. Крупные фракции гравия в нижних слоях фильтра равномерно распределяют ток воды через верхние слои. В-третьих, часть детрита, плотно прилипшего к поверхности песчинок, удаляется, когда они всплывают и трутся друг о друга.
Для текущих очисток больших гравийных фильтров целесообразно применять быстрые песчаные фильтры типа, показанного на рис. 2.5. В морских аквариумах, удаленных от моря, из-за высокой стоимости искусственной воды удаление детрита путем сброса большого количества загрязненной воды невыгодно. Современные схемы предусматривают очистку промывной воды с гравийных фильтров на дополнительных быстрых песчаных фильтрах, которые устанавливаются в паре с гравийным фильтром. После промывки гравия взвешенный в воде детрит оседает на песчаном фильтре, а чистая вода снова подается в аквариум.
Очистка диатомовых фильтров. Большинство крупных диатомовых фильтров очищают обратной промывкой, хотя некоторые открытые системы очищают, спуская воду из фильтровального отсека, а затем смывают грунт сильной струей воды из шланга. Во время промывки ток воды меняют на противоположный, направляя его через сердечники. В результате фильтровальный рукав растягивается и с него смывается слой диатомового грунта, который затем удаляется с отходами (рис. 2.13). Для промывки следует использовать только водопроводную воду, даже если фильтр установлен в морском аквариуме. Это предотвращает закупорку пор рукава органическим материалом и снижение эффективности работы оборудования.
Фильтровальные рукава следует периодически снимать с сердечников и стирать для удаления детрита. Можно воспользоваться стиральной машиной, добавляя стиральный порошок и умягчители воды. Полипропиленовая ткань чувствительна к температурным воздействиям, поэтому ее нельзя стирать в горячей воде. Слишком горячая вода расплавляет материал, промежутки между нитями сужаются. Следует пользоваться только холодной или теплой водой. После стирки,рукава следует несколько раз прополоскать в чистой воде для удаления остатков стирального порошка.
Иногда фильтровальные рукава засоряются. Признаками засорения являются сокращение интервалов между промывками и наличие незаполненных участков на ткани рукава после грунтовки. Причиной засорения могут быть отложение органических веществ, карбонатных солей, осаждение окислов железа и магния или обрастание водорослями. Обычно засорение вызывается накоплением органических веществ, которые можно удалить стиркой. В морской и пресной воде с высокой жесткостью (из артезианских скважин) главной причиной зазрения становятся окислы железа, магния и соли кальция. Обрастание водорослями встречается как в морских, так и в пресноводных аквариумах, подверженных действию прямых солнечных лучей, с высоким содержанием в воде азотистых и фосфорных соединений.
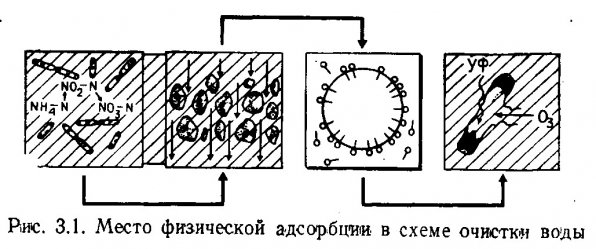
Растворенное органическое вещество (РОВ) может быть удалено из аквариумной воды путем физической адсорбции на активном угле или в пеноотделительных колонках. Неорганические биогенные вещества (аммоний, нитраты, фосфаты) удаляются из воды в ионообменниках. Ионообмен не относится к физическим процессам адсорбции, но для удобства он включен в эту главу. Гранулированный активный уголь и пеноотделительные колонки эффективны в пресной, солоноватой и морской воде; ионообменники используются только для очистки пресной воды. В схеме очистки воды физическая адсорбция следует за биологической очисткой и механической фильтрацией и предшествует дезинфекции (рис. 3.1). Ионообмен завершает схему физической адсорбции.
Адсорбция определяется как осаждение растворенного органического вещества (POB) на специальных средах. Средой может служить граница между двумя фазами вещества, одной из которых является аквариумная вода. Другой фазой может быть, например, газ в воздушных пузырьках в пеноотделительных колонках (контакторах) или твердое вещество, например гранулы активного угля. При адсорбции извлекаемое из воды вещество (адсорбат) оказывается связанным с одной из фаз — газообразной или твердой (адсорбентом). Если химические связи сильны, процесс адсорбции необратим и возникает еще и химическая адсорбция. Если связи слабы и осуществляются, например, за счет сил Ван-дер-Ваальса, то происходит только физическая адсорбция. Слабые связи означают обратимость адсорбционного процесса, что часто бывает связано с изменением концентрации адсорбата. Десорбция — процесс, обратный адсорбции, при котором осажденный на границе двух сред адсорбат вновь переходит в раствор.
3.1. Очистка воды активным углем
Некоторые компоненты растворенного органического вещества (POB) могут быть извлечены из аквариумной воды активным углем. Активный уголь готовят в два этапа. Первый этап — обжиг, во время которого такие углеродсодержащие материалы, как уголь, кости животных, древесину или скорлупу орехов, нагревают до красного каления (около 600 С) для удаления углеводородов. Во избежание полного сгорания обжиг производят фактически без доступа воздуха. Следующий этап — активация. Обжиг повторяют на этот раз при температуре 900 С в присутствии окисляющего газа. Этот газ создает внутреннюю пористую поверхность угля, на которой впоследствии будут оседать извлеченные из воды РОВ (рис. 3.2). При удалении адсорбата из жидкой среды размер пор, как правило, не имеет большого значения (Tchobanoglous, 1972).
Применяют гранулированный или порошкообразный активный уголь. Хотя порошкообразный уголь имеет большую связывающую поверхность, он неудобен в эксплуатации и относительно дорог, поэтому в дальнейшем рассматривается в основном гранулированный уголь. Гранулированный называют активный уголь (ГАУ) с частицами размером более 0,1 мм (Tchobanoglous,1972).
Факторы, влияющие на эффективность адсорбции. Эффективность адсорбции растворенного органического вещества на ГАУ зависит от нескольких факторов, важнейшими из которых являются массоперенос адсорбата в гранулы угля, продолжительность контакта, концентрация и происхождение адсорбата, размер гранул, площадь поверхности пор и однородность фракций активного угля, наличие органической пленки на поверхности гранул. Температуру и рН как факторы, влияющие на адсорбцию, можно не учитывать, поскольку в аквариумах они должны поддерживаться в узком диапазоне, обеспечивающем нормальную жизнедеятельность животных и растений. Из этих двух факторов рН, по-видимому, важнее. Моррис и Вебер (Morris and Weber, 1964) отмечали, что адсорбционное равновесие не подвержено влиянию колебаний температуры воды, особенно в диапазоне, характерном для природных вод.
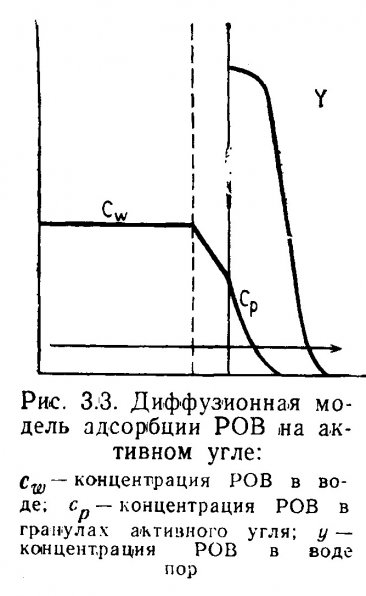
Чобаноглоус (Tchobanoglous, 1972) выделял в процессе адсорбции три самостоятельных этапа: перенос адсорбата слой воды и биологическую пленку, окружающую адсорбент, проникновение в поры ГАУ, образование химических связей между молекулами адсорбата и активированного угля. Первые два этапа зависят от продолжительности контакта, третий происходит мгновенно. Таким образом, молекулярный массоперенос лимитируется первыми двумя этапами (рис. 3.3) .
Продолжительность контакта между водой, содержащей РОВ, и активным углем имеет принципиальное значение. Если продолжительность контакта очень мала, массопереноса не происходит. Увеличение продолжительности контакта достигается удлинением контактной колонки или уменьшением расхода воды через контрактор.
Скорость адсорбции частично изменяется как корень квадратный из величины концентрации адсорба в растворе (Morris and Weber, 1964).
Следовательно, из слабо-насыщенного раствора за единицу времени извлекается больше адсорбата вплоть до удаления следов РОВ из раствора. Тем не менее скорость адсорбции возрастает с увеличением концентрации загрязнителя в растворе, но эта зависимость носит нелинейный характер. Моррис и Вебер (1964) обнаружили также, что крупные молекулы (с большой молекулярной массой) осаждаются медленнее, чем мелкие. Более того, конфигурация молекул оказывала влияние на скорость их осаждения: молекулы с сильно разветвленной цепью адсорбировались медленнее, чем молекулы со сходной молекулярной массой, но более компактные по структуре.
Скорость адсорбции частично изменяется как квадрат диаметра отдельных гранул активного угля (Morris and Weber, 1964). Как уже отмечалось, скорость диффузии органических молекул на границе воды и активного угля ограничена массопереносом в поры адсорбента. В свою очередь размеры гранул активного угля влияют на скорость массопереноса; на более мелких частицах извлечение РОВ из воды происходит быстрее. Вместе с тем измельчение крупных гранул активного угля, хотя и создает дополнительные поры, не приводит к ощутимому увеличению скорости адсорбции (Morris and Weber, 1964).
Площадь поверхности пор ГАУ может быть выражена в общем виде мелассовым, фенольным или йодным числом. Молекулы каждого из этих химических веществ имеют разный размер, и степень, с которой оно может быть адсорбировано, зависит от числа пор определенного размера на поверхности гранул активного угля. Молекулы йода как самые мелкие дают представление об общей площади поверхности пор. Мелассовое число характеризует число крупных пор, а фенольное — промежуточных по величине пор. Иодное, мелассовое и фенольное число позволяют приблизительно судить о потенциальной адсорбционной способности активного угля данного сорта. Однако Сонтимер (Sontheimer,1974), испытывая ГАУ трех сортов в опытах по удалению общего органического углерода из сбросных вод, не обнаружил определенной зависимости адсорбционной емкости гранул ни от фенольного числа, ни от площади поверхности пор.
Последний фактор, определяющий скорость адсорбции— это образование органической пленки. Гранулы, помещенные в воду, очень быстро покрываются пленкой слизи, вырабатываемой бактериями. С одной стороны, она препятствует прониканию в ГАУ тяжелых молекул РОВ (NcCreary and Snceyink, 1977), с другой — обеспечивает удаление РОВ из воды, после того как физическая адсорбционная способность колонки с гранулированным углем исчерпана (Maqsood and Benedek, 1977). Последний процесс обусловлен длительностью гетеротрофных бактерий, населяющих слизь.
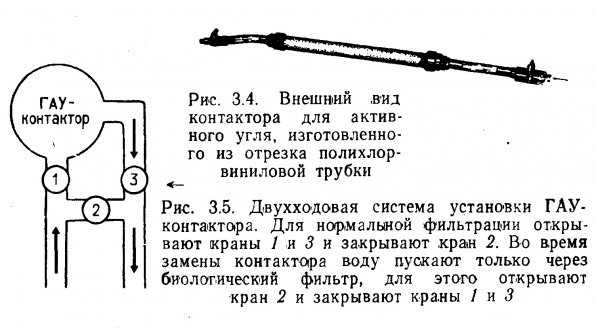
Устройство ГАУ-контакторов. Гранулы активного угля обычно помещают в отдельный контейнер, так называемый контактор. Засыпание гранул прямо на фильтровальный слой неудобно, так как отработанные гранулы необходимо периодически отделять от гравия и удалять из аквариума. В небольших аквариумах в качестве контактора можно использовать стандартный угловой фильтр с эрлифтом. Для защиты гранул активного угля от слизи поверх них укладывают плотный слой стекловаты.
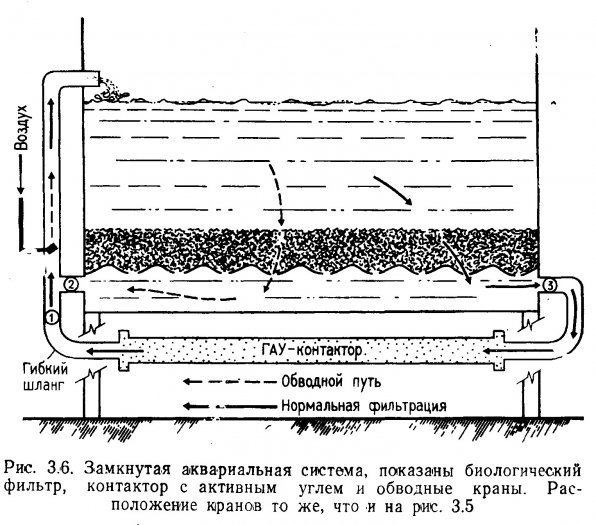
Для крупных аквариумов контактор можно изготовить из отрезка полихлорвиниловой трубки (рис. 3.4). Для удобства на обоих концах контакторной трубки делается резьба и навинчиваются съемные переходные муфты. На выходном конце трубки во избежание выноса частиц угля в эрлифт устанавливают пористую пластинку, кусочек капронового сита или пробку из стекловаты. К выходному концу контакторной трубки присоединяют гибкий шланг с наконечником, снабженным краном. В схему включен перепускной клапан (рис. 3.5), чтобы воду можно было пустить через биологический фильтр, когда контактор отключен для перезарядки. В идеале контактор следует устанавливать сразу за биологическим фильтром (рис. 3.6). В результате гетеротрофных окислительных процессов многие компоненты РОВ минерализуются, что снижает нагрузку на активный уголь и продлевает срок его службы.
Контакторы, показанные на рис. 3.4 и 3.6, заменяются после переключения тока воды обратно в аквариум, затем отсоединяются передняя и задняя муфты. Эта процедура облегчается, если вместо жестких полихлорвиниловых трубок применяются гибкие соединительные шланги. Отработанный ГАУ заменяют новым, предварительно промытым в чистой водопроводной воде для удаления пыли. Во избежание просачивания воды в сочленениях нарезные концы оборачивают тефлоновой лентой.
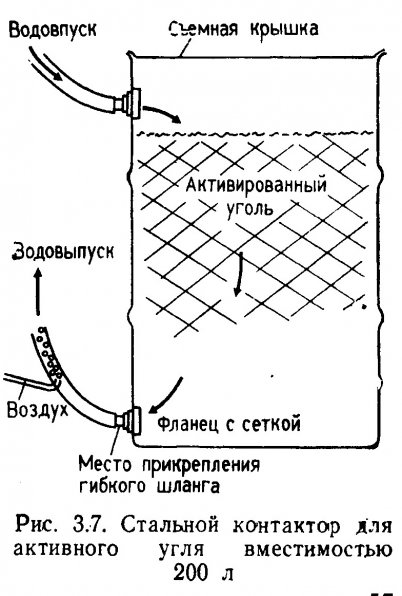
ГАУ-контакторы для очень больших аквариумов можно изготовить из 200-литровой стальной бочки со съемной крышкой (рис. 3.7). Для защиты от коррозии внутренние поверхности бака и крышки покрывают двумя слоями эпоксидной краски. В стенке бочки высверливают два отверстия (диаметром 2,54 см): одно сверху, другое снизу. В отверстия вставляют нарезные полихлорвиниловые фланцы диаметром 2,54 см и закрепляют их изнутри вместе с уплотнительной шайбой болтами из нержавеющей стали, на наружные концы фланцев навинчивают гибкие полихлорвиниловые шланги. Если на внутренний конец фланца натянуть пластиковую сетку, отпадает необходимость устройства платы, как это делается в гравийном фильтре. Сетка предотвращает засасывание эрлифтом частиц активного угля в аквариум. Вода должна подаваться в контур по обходному пути через фильтр, как показано на рис. 3.5. Бочка заполняется на 3/4 промытым ГАУ. Одной заправки хватает для очистки 4000л. аквариумной воды.
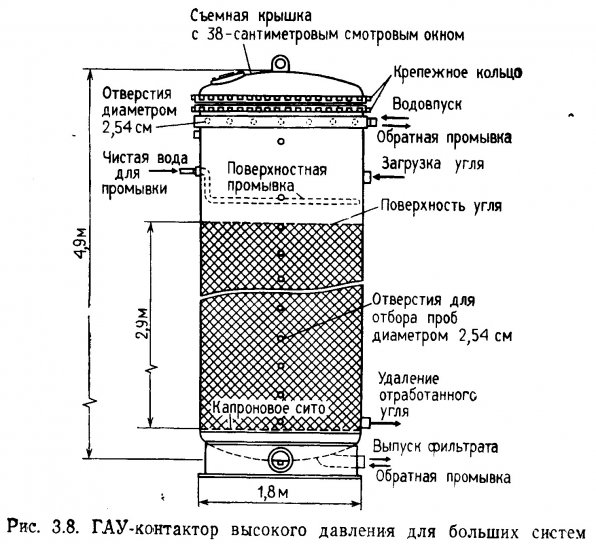
Для очистки крупных аквариальных систем требуется контактор с механическими насосами. Для этих целей пригодны также большинство песчаных фильтров высокого давления. Вместо песка и гравия эти установки наполняют активным углем. Фильтр целесообразно снабдить съемной крышкой, так как активный уголь необходимо периодически менять (рис. 3.8).
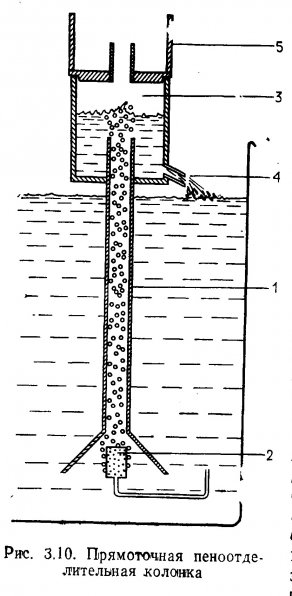
3.2. Адсорбция в пеноотделительных колонках (скиммерах).
Многие поверхностно-активные фракции РОВ могут быть сконцентрированы и удалены с пеной в пеноотделительных колонках. Этот процесс называют также воздушным осаждением или сепарированием белка. Последнее определение не совсем верно, так как предполагает удаление РОВ в пеноотделительных колонках происходит двумя путями: поверхностно-активные вещества осаждаются путем физической адсорбции на поверхности воздушных пузырьков в пеноотделительных колонках; между поверхностно-неактивными и поверхностно-активными веществами могут возникать химические связи, и они удаляются вместе. В пеноотделительных контакторах (или просто пеноотделителях) вместе с пеной частично удаляются и взвешенные органические вещества, т.е. в них осуществляется дополнительная механическая фильтрация. Взвешенные в воде микроорганизмы входят в состав ВОВ, и Шлеснер и Рейнхеймер (iSchlesner and Rheinheimer, 1974) показали, что пеноотделители снижают число свободноплавающих в аквариумной воде микроорганизмов.
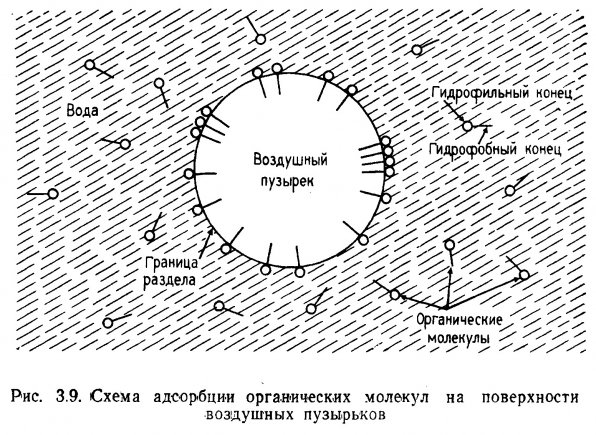
В воде молекулы поверхностно-активных веществ поляризованы. Один конец, вокруг которого концентрируются молекулы воды, гидрофильный, другой - гидрофобный. Как следует из названия, поверхностно-активные молекулы стремятся скапливаться у поверхности, причем таким образом, что их гидрофильные концы погружены в воду, а гидрофобные контактируют с воздухом (рис. 3.9). Это позволяет им концентрироваться на поверх с воздушных пузырьков.
Адсорбция в пеноотделительных колонках не снижает содержания амномония в воде, как обычно считается, поскольку рН в аквариуме нельзя изменять без риска для животных и растений. Кюн (Kuhn, 1956) показал, что заметное снижение содержания аммония в сбросных водах, обрабатываемых в пеноотделительных колонках, достигалось только при увеличении рН до 11.
Факторы, влияющие на эффективность пеноотделения. Эффективность очистки воды в пеноотделительных колонках зависит от продолжительности контакта воздушных пузырьков с водой и от их размеров. Продолжительность контакта в свою очередь зависит от расхода воды в колонке, ее высоты и объема подаваемого воздуха. Для увеличения продолжительности контакта воды с воздушными пузырьками применяют различные способы, основными из которых являются увеличение длины колонки и уменьшение расхода воды. У мелких пузырьков отношение площади поверхности к объему больше, чем у крупных, что предпочтительнее.
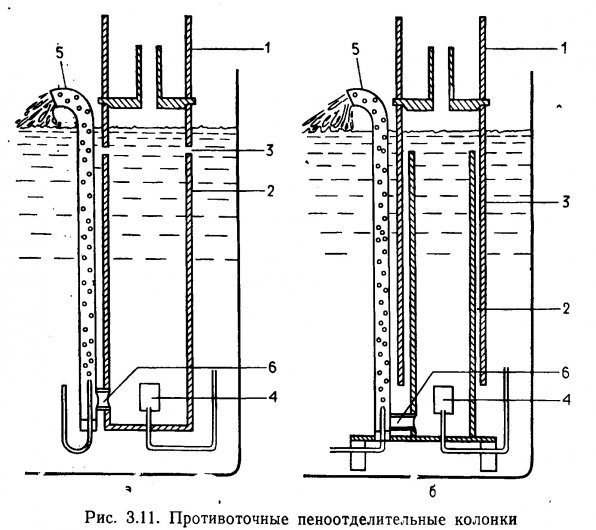
Конструкция пеноотделительных колонок. На рис. 3.10 и 3.11 представлены три конструкции пеноотделительных колонок, применяемых для очистки воды в аквариумах. Устройства, показанные на рис. 3.11, можно использовать в акваримных системах большого объема. На рис. 3.10 представлен прямоточный вариант, когда пузырьки воздуха в пеноотделительной колонке поднимаются вместе с током воды, а на рис. 3.11 — противоточный, когда ток воды идет навстречу поднимающимся пузырькам. Принцип противотока обеспечивает более продолжительный контакт, так как вода, встречаясь с пузырьками воздуха, уравновешивает их и замедляет скорость подъема.
В колонках прямоточной системы воздух из компрессора распыляется через диффузор 2 (см. рис. 3.10). По мере подъема пузырьки 1 перемешиваются, или «контактируют», с водой. Поверхностно-активные фракции РОВ оседают на поверхности пузырьков, образующих пену на границе воздуха и воды 3. По мере накопления пена попадает в камеру-коллектор 5. Коллектор съемный, легко доступен для промывки. Очищенная вода возвращается в аквариум через отверстие 4. В противоточных, конструкциях вода подается против направления движения воздушных пузырьков. На рис. 3.11,а воздух из компрессора поступает через диффузор 4 в контактную колонку 2. Неочищенная вода из аквариума подается в колонку через верхнее отверстие 3. При такой конструкции верхняя часть колонки служит разделительной камерой. Избыток пены поступает в коллектор 1, который легко снимается для промывки. Очищенная вода забирается снизу, проходит через соединительную трубку 6 возле дна колонки и с помощью эрлифта возвращается в аквариум 5. Конструкция, представленная на рис. 3.11,б, аналогична описанной с той разницей, что контактная колонка 2 заключена во внешний кожух З. Преимущество такой конструкции заключается в том, что неочищенная вода не может выноситься с воздухом обратно в аквариум, как в схеме 3.11,а (через отверстие 8), поэтому конструкция на рис. 3.11,б несколько эффективнее.
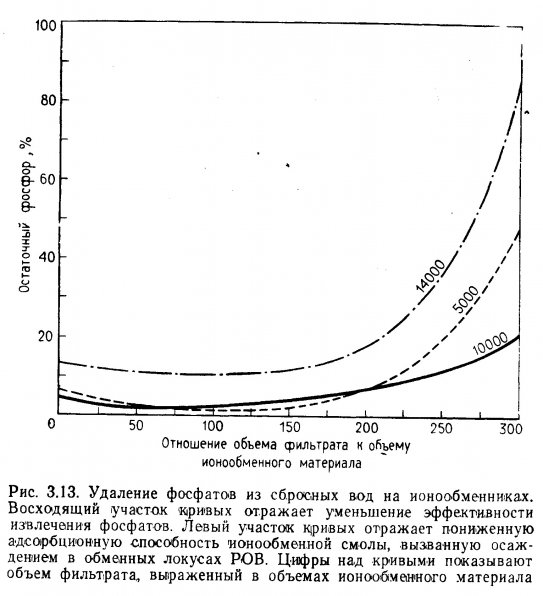
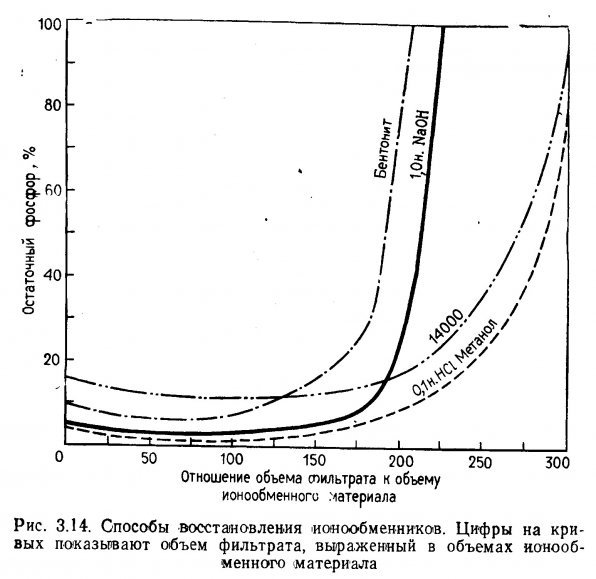
Ионообменные материалы, состоящие из природных цеолитов или синтетических смол, очень эффективны при удалении некоторых нежелательных компонентов из аквариумной воды. Применение ионообменников возможно в основном только в пресноводных системах, так как присутствие в солоноватой и морской воде множества других ионов ограничивает число свободных точек (локусов) для связывания загрязнителей. Ионообмен как способ очистки аквариумной воды, как правило, не применяется. Это тем более странно, что в правильно отрегулированных системах с помощью ионообмена можно извлечь из раствора до 90% ионов аммония, нитратов и фосфатов.
Ионообменными материалами называют гранулированные цеолиты или синтетические смолы, несущие электрохимический заряд и способные извлекать из раствора специфические ионы путем обмена их на ионы другого типа, но с тем же электрохимическим зарядом. По классификации Кунина (Kunin, 1963) ионообменные смолы подразделяются на сильные и слабые катиониты и сильные и слабые аниониты.
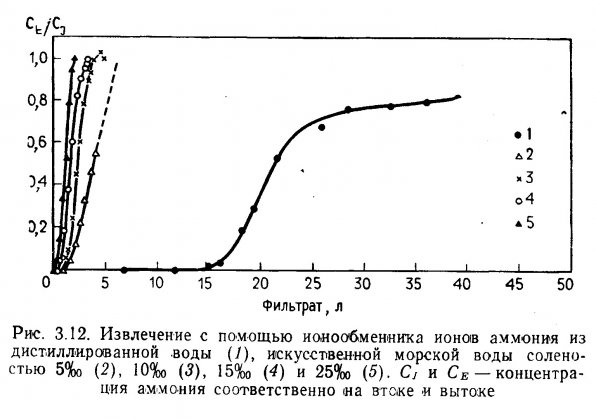
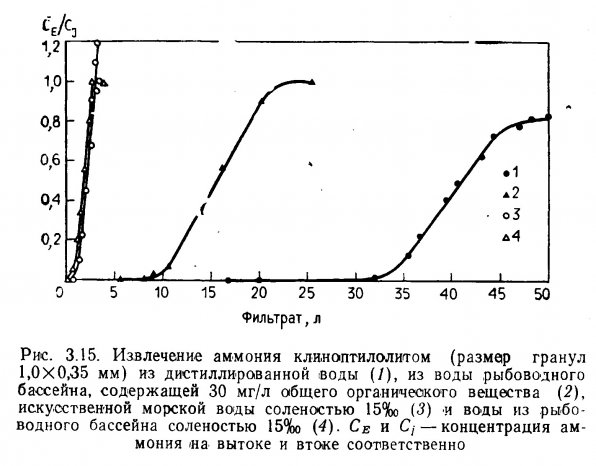
Извлечение ионов аммония. Вопросы удаления ионов аммония из сбросных вод путем ионообмена рассматриваются в многочисленной литературе (Nesselson, 1954; Culp and Slechta, 1966; Battelle Memorial Institute, 1969; Koon and Kaufman, 1971; 1975; Jorgensen et al., 1976). Йоргенсен и др. (1976) изучали извлечение ионов аммония (NH4-) с помощью клиноптилолита — природного цеолита. Было обнаружено, что этот материал действует одновременно как ионит (ионообменник) и как адсорбент. Точка насыщения составила приблизительно 8,0 ммоль NH4 — N на 100 г. При увеличении продолжительности контакта до 120 мин. эффективность адсорбции и ионообмена возрастала.
Спотт (Spotte, 1970) предположил, что ионообмен можно использовать для удаления ионов биогенных веществ, включая аммоний, из воды аквариумов и инкубационных цехов рыбоводных предприятий. Эффективность этого процесса была подтверждена Джонсоном и Сибертом (Johnson and Sieburth, 1974) и Коникоффом (Koniкой, 1974). Джонсон и Сиберт обнаружили, что как клиноптилолит, так и ионообменные смолы уменьшали содержание аммония (общий ХН4 — М) в пресной воде лососевого питомника. Коникофф отметил, что при высокой плотности посадки канального сомика в пресноводные бассейны концентрация аммония в бассейне, оборудованном клиноптилолитовой колонкой, была значительно ниже, чем в контрольном, где применялся обычный биологический фильтр. Однако последующее увеличение содержания нитритов вызвало высокую смертность рыбы в обоих бассейнах. В воде контрольного бассейна содержание аммония, нитратов, фосфатов, кислотность и удельная электропроводность воды постепенно увеличивались, а щелочность и рН снижались. В бассейне, где вода фильтровалась через клиноптилолитовую колонку, содержание аммония, фосфатов и кислотность воды по сравнению с контролем были ниже. Содержание нитратов и удельная электропроводность были такими же, как в контрольном бассейне, а щелочность и рН выше.
Возможность использования ионообмена для удаления нитратов и фосфатов из воды аквариумов и акваримных систем специально не изучалась, но некоторые факторы, обусловливающие извлечение этих веществ из сбросных вод, рассматриваются ниже.
Факторы, обусловливающие эффективность ионообмена. Эффективность ионообмена в значительной степе ни зависит от межионного взаимодействия, степени заполнения обменных локусов молекулами растворенных органических веществ и размеров гранул ионообменников.
Межионное взаимодействие. Эффективность удаления ионов аммония зависит от катионной силы поступающей воды, т. е. от ионной силы раствора, рассчитанной только по катионам.
Ионная сила может быть рассчитана по формуле.
Изучая процесс очистки сбросных вод с помощью ионообменников, Кун и Кауфман (1975) обнаружили, что при связывании ионов аммония обменная емкость клиноптилолита резко снижалась, когда катионная сила раствора возрастала до 0,01 М/л. По мере дальнейшего увеличения катионной силы раствора обменная емкость ионита продолжала снижаться, но в меньшей степени. Джонсон и Сиберт (1974) также отмечали, что эффективность удаления ионов аммония из воды лососевого рыбопитомника с помощью клиноптилолита резко снсжалась при увеличении ионной силы раствора. При солености воды, равной всего 5%, извлечение общего NH4 — N уменьшалось в 10 раз (рис. 3.12). При солености, равной 10,15 и 25%, эффективность ионообмена еще больше снижалась, но не так резко, как при солености 5%.
Удаление нитратов и фосфатов из воды с высокой ионной силой также, затруднено. Элиассен и др. (Eliassen et al., 1965) отмечали, что при высоком содержании хлоридов в сбросной воде снижается число обменных локусов, необходимых для контакта с нитратами и фосфатами. Высокое содержание сульфатов также затрудняло ионообмен. Бьюлоу и другие (Buelow et al., 1975), изучая эффективность извлечения нитратов из воды с различной ионной силой, показали, что обменная способность ионообменных смол в значительной степени зависит от общей концентрации анионов в протекающей воде. В некоторых случаях последовательность извлечения ионов может измениться на противоположную. В воде с небольшой ионной силой сульфаты адсорбируются лучше нитратов, но при увеличении ионной силы протекающей воды, наоборот, нитратов извлекается больше, чем сульфатов. Все проведенные опыты позволили выявить одну закономерность: как катиониты, так и аниониты в растворах со слабой ионной силой предпочитают взаимодействовать с поливалентными ионами.
Бьюлоу и др. (1975) показали, что если в воде присутствует окись кремния, то она, покрывая поверхность ионообменных смол, препятствует обмену нитратов. Наиболее серьезной помехой являются ионы сульфатов, а также хлориды и бикарбонаты. В слабых растворах эти ионы извлекаются ионитами в следующем порядке: сульфаты – нитраты – хлориды - щелочные ионы (сумма карбонатов и бикарбонатов). В более насыщенных растворах сульфаты и нитраты меняются местами.
Отбор ионов из воды, а следовательно, и эффективность ионообмена зависят главным образом от межионного взаимодействия. Отбор ионов резко снижается с увеличением ионной силы поступающей неочищенной воды. С практической точки зрения в морской, солоноватой и даже жесткой пресной воде ионообменный процесс малопроизводителен. Иоргенсен и др. (Jorgensen et a1., 1976) отмечали, что по сравнению с дистиллированной в загрязненной воде удаление ионов аммония происходит гораздо менее эффективно из-за присутствия ионов кальция. Аналогично Элиассен и др. (1965) указывали, что присутствие в сбросной воде хлоридов (200 мг/л) и сульфатов (65 мг/л) значительно затрудняло извлечение нитратов и фосфатов в ионообменниках. Учитывая, что в морской воде ионы кальция, хлориды и сульфаты присутствуют в концентрации 400,1,9Х10'4 и 885 мг/л соответственно, легко понять, почему быстро связываются активные центры на ионообменниках, и они выходят из строя прежде, чем успевают извлечь из воды значительное количество биогенных веществ. Дейви и др. (Davey et al., 1970) и Шётс (Schietz, 1976) отмечали способность ионообменных смол извлекать из морской воды ионы редких металлов, что, безусловно, верно, однако детально этот процесс они не разбирали.
Загрязнение ионитов органическими соединениями. Присутствие в воде растворенных органических соединений отрицательно влияет на обмен неорганических ионов. Органические вещества загрязняют поверхность ионообменного материала, уменьшая число локусов для связывания неорганических соединений (Jorgensen et al., 1976; Frisch and Кцп1п, 1960). Органическое загрязнение в процессе удаления фосфатов из сбросных вод рассматривали Элиассен и др. (1965). Полученные ими результаты показаны на рис. 3.13. Осевшие на ионообменных материалах органические вещества можно удалить с помощью гидроокиси натрия, соляной кислоты, метанола либо обратной промывкой ионообменной колонки бентонитом, который, действуя как скребок, очищает поверхность ионитов. Как видно из рис. 3.14, бентонит обеспечивает наиболее эффективную очистку. Элиассен обнаружил, что органические вещества, покрывающие поверхность ионообменных смол, непосредственно в ионообмене не участвуют, а образуют мономолекулярную пленку. Джонсон и Сиберт (1974) показали, что при содержании общего органического углерода 30 мг/л клиноптилолит перестает связывать ионы аммония. В результате при удалении 95% аммония из дистиллированной воды количество очищенной воды составляло всего половину исходного (рис. 3.15).
Размер гранул ионообменного материала. Размеры частиц ионообменного материала влияют на его адсорбционную емкость. Мелкие гранулы имеют большую поверхность контакта с водой. Иоргенсен и др. (1976), работая с ионообменными смолами для удаления ионов аммония из сбросных вод, отмечали, что при размере гранул 2,5 - 5 мм статичная емкость была на уровне 0,47 мэкв. NH4 — N на 1 г ионита, а при 1,4-2 мм — 0,62 мэкв./r. Джонсон и Сиберт (1974) также отмечали, что более крупные гранулы ионообменников были менее эффективны при удалении ионов аммония. Они показали, что оптимальные размеры частиц клиноптилолита составляют 1*0,35 мм.
Устройство ионообменных колонок. При конструировании ионообменного контактора необходимо учитывать свойства ионообменного материала и некоторые особенности ионообменной колонки.
Выбор ионообменного материала. Трудно заранее предсказать, как поведет себя тот или иной ионит в конкретных условиях. Бьюлоу и др. (1975) подчеркивали, что экспериментальную очистку следует производить в реальных производственных условиях, а не на дистиллированной воде или модельных растворах, Они отмечали, что порядок извлечения ионов из загрязненной воды и их взаимодействие с ионами данного ионита из-за непостоянной ионной силы раствора могут изменяться даже на противоположные. В растворах большой ионной силы нитраты адсорбируются прежде сульфатов, при снижении ионной силы притекающей воды ситуация меняется на противоположную. Извлечение ионов аммония продолжается даже при увеличении ионной силы раствора. Таким образом, эффективность процесса возрастает, когда межионные взаимодействия сведены к минимуму независимо от вида извлекаемых ионов. Общее сродство ионообменных материалов к трем основным неорганическим,ионам-загрязнителям приведено в табл. 3.1. Следует отметить, что эти данные приведены только для сведения и не заменяют предварительных исследований.
Выбор ионообменника зависит от химической природы иона-загрязнителя и ионной силы воды, которую предстоит очищать. Анионы (например, нитраты и фосфаты) осаждаются на анионитах, катионы (например, ион аммония) извлекаются из воды положительно заряженными ионитами (катионитами). Слабые иониты, если они справляются с поставленной задачей, предпочтительнее сильных, так как легче поддаются регенерации. В некоторых случаях иониты, которые за один проход воды связывают большое количество загрязнителя, неудобны. Для аквариумистов важнее то, насколько ионообменный материал сохраняет свои свойства после многократного восстановления. Бьюлоу и др. (1975) отмечали, например, что ионообменные смолы, которые извлекают большое количество исходных нитратов, труднее поддаются регенерации.
Кун и Кауфман (1975) установили, что для удаления ионов аммония наиболее пригоден клиноптилолит, хотя смолы, испытанные Джонсоном и Сибертом (1974), также оказались эффективными. Сильноосновные аниониты в хлоридной форме пригодны для извлечения нитратов из сбросных вод (Buelow et al., 1975; Nesselsоn, 1954). Элиассен и др. (1965) извлекали из загрязненной воды до 92% нитратов и 95% фосфатв, используя сильноосновной анионит, а Мартинезу (Martinez, 1962), который применял ионообменник того же типа, но изготовленный на другом предприятии, удалось извлечь из сбросной воды до 99% нитратов и 98% фосфатов.
Ионообменная колонка. Ионообменный материал помещают в контактную колонку, размеры которой определяют исходя из объема обрабатываемой воды. Для этой цели пригодны колонки для активного угля (см. рис. 3.4 и 3.6). В очень больших водных системах в качестве ионообменной колонки может быть приспособлен быстрый песчаный фильтр высокого давления (рис. 3.16).
Важно правильно разместить ионообменную колонку в системе очистки воды. Иоргенсен и др. (1976) советуют устанавливать ионообменники в схеме после контактора с активированным углем, чтобы уменьшить загрязнение ионообменного материала растворенными органическими веществами. Перед колонкой с углем должен стоять эффективный механический фильтр. Этим достигается снижение содержания органических взвесей и предотвращается засорение поверхностных слоев активного угля и ионообменных смол.
В процессе физической адсорбции из растворов удаляются различные микроэлементы. Это не имеет большого значения, если в аквариуме не посажены растения, в противном случае раз в 2 недели приходится заменять 10% аквариумной воды.
Активный уголь. Адсорбционная способность активного угля по мере эксплуатации постепенно снижается, и в конце концов материал приходится заменять или восстанавливать. В противном случае возникает десорбция, а растворенные органические вещества из пор адсорбента вновь переходят в раствор. Реактивация предусматривает обжиг гранул угля при высокой температуре под давлением. Однако даже при таком режиме раскрываются только самые крупные поры (Joyce and Sukenik, 1964), поэтому с каждой реактивацией адсорбционная способность гранул снижается и, по-видимому, она никогда не достигает исходного значения.
Рекомендуется брать 1 г гранул на 1 л аквариумной воды и полностью заменять адсорбент каждые 2 мес. Минерализация растворенных органических веществ гетеротрофными бактериями, поселяющимися на поверхности гранул, создает впечатление, что адсорбент еще работает, хотя на самом деле его адсорбционная способность уже исчерпана (Naqsood and Benedek, 1977). Единственный способ, позволяющий зарегистрировать начало десорбции,— постоянно следить за содержанием общего органического углерода (окисляемостью) в выходящей из адсорбционной колонки воде.
Пеноотделительный процесс. В пеноотделительных колонках, снабженных эрлифтами, объем распыляемого воздуха такой же, как и в обычных эрлифтах сходного размера (см. табл. 5.1). Степень погружения такая же, как в эрлифтах,и вытекающая вода должна выходить плавной струей. Если объем подаваемого воздуха превосходит вместимость трубы эрлифта, продолжительность контакта воды с воздухом нестабильна. Адсорбция частично зависит от площади поверхности воздушных пузырьков, поэтому в месте подачи воздуха обязательно устанавливают распылительную насадку.
Ионообмен. Природную воду с высоким содержанием железа или марганца следует предварительно очистить осаждением, интенсивной аэрацией или окислением озоном либо перманганатом калия. Бьюлоу идр. (1975) обнаружили, что осадок железа затруднял извлечение нитратов из воды. Осадок можно удалить обработкой смол 1,0 н. раствором НСl и обратной промывкой. Высокое содержание железа и марганца обычно свойственно воде из артезианских скважин.
Ионообменный процесс протекает очень быстро и зависит от числа свободных обменных локусов (т. е. от количества, ионообменного материала) и расхода воды. Эти факторы определяют опытным путем в предварительных исследованиях для конкретного расхода воды или эмпирически, контролируя продолжительность работы ионообменника, пока не появятся признаки его истощения, затем согласованно регулируют расход воды и объем ионита. Истощение определяют по скачкообразному повышению содержания биогенных веществ в вытекающей воде.
В табл. 3.2 приведено количество регенеранта для восстановления ионообменных смол. Большинство ионообменных материалов эффективно восстанавливается раствором хлористого натрия. Корнголд (Korngold, 1972) рекомендует использовать для этих целей морскую воду, что удобно для пресноводных аквариумных систем, расположенных в приморской зоне. При определении концентрации регенеранта для начала рекомендуется применить 10%-ный раствор хлористого натрия.
Бьюлоу и др. (1975), например, обнаружили, что в воде небольшой ионной силы регенерация ионообменной смолы происходила при добавлении 0,359 кг NaCl на 1 м.куб, в то время как для воды большей ионной силы потребовалось 1,366 кг NaCl на 1 м.куб. Для воды из двух артезианских скважин потребовалось 0605 и 0.628 кг/м.куб хлористого натрия. Для конкретных условий количество регенеранта устанавливают опытным путем.
Хлористый натрий и другие регенеранты, например те, которые использовали Элиассен и др. (1965) (едкий натр, метанол, соляная кислота), могут либо быть непосредственно токсичны для рыбы, либо вызывать существенные изменения рН в воде со слабыми буферными свойствами. Регенеранты и моющие средства следует вносить, соблюдая осторожность. Обычно ионообменную колонку на период восстановления отключают от аквариумной системы. После обработки контактную колонку необходимо тщательно промыть чистой водой.
Дезинфекцией называют процесс уничтожения патогенных микроорганизмов различными химическими и физическими способами. Аквариумную воду обычно дезинфицируют ультрафиолетовым (УФ) излучением или озонированием. Оба процесса снижают численность свободноплавающих микроорганизмов, но не оказывают влияния на инфекционные и паразитические организмы, живущие непосредственно на животных. Таким образом, дезинфекция способна предотвратить заражение, но не может заменить антибиотики и другие хемотерапевтические средства, применяемые при лечении заболеваний.
На результаты дезинфекции отрицательно влияет присутствие'в воде растворенных и взвешенных органических соединений, поэтому ультрафиолетовые стериЛизаторы и озонаторы помещают в схеме очистных сооружений после биологических, механических фильтров, а также физических контакторов (рис. 4.1).
4.1. Ультрафиолетовое облучение аквариума
Ультрафиолетовое излучение убивает микроорганизмы в воде, непосредственно воздействуя на ДНК (дезоксирибонуклеиновую кислоту) в клетке. УФ-лампы создают излучение, а процесс обработки воды называют облучением.
Факторы, влияющие на степень поражения. Эффективность ультрафиолетовых стерилизаторов зависит от размеров организмов, интенсивности генерируемого излучения и глубины проникновения УФ-лучей в воду. Обычно, чем крупнее микроорганизмы, тем устойчивее они к воздействию УФ-лучей. Большинство вирусов, бактерий, микроскопических грибов и простейших могут быть обезврежены облучением интенсивностью 35000 мкВт*с/см2 (микроватт в секунду на 1 см2 поверхности ультрафиолетовое лампы). Более крупные микроорганизмы, например инфузорию Jchthyophthirius, на стадии свободноплавающих «бродяжек», по данным Хофмана (Hoffman, 1974), приходится обрабатывать излучением большей мощности - до 400000 мкВт*с/см2. Для обезвреживания взрослых паразитов, которые поселяются на коже и жабрах рыб, требуется доза, равная примерно 1717200 мкВт*с/см2, при условии, что инфузории предварительно отделены от хозяина (Vlasenko, 1969). Такие различия в летальных дозах обусловлены резкими колебаниями размеров паразитов во взрослом состоянии и на стадии «бродяжек» (800 мкм по сравнению с 20Х35 мкм). Динофлагелята Oodinium ocelIatum — жгутиконосец, паразитирующий на морских рыбах на диноспорной (свободноплавающей) стадии развития, вероятно, может быть обезврежена дозой 35000 мкВт*с/см2, однако экспериментально это не проверялось. Минимальная летальная доза (МЛД) для «бродяжек» другого опасного паразита морских рыб инфузории Cryptoearyon irritans — может достигать 800000 мкВт*с/см2, однако это также только предположение. Подобный вывод основан на сходстве их размеров [35Х56 мкм (Nigrelli and Ruggieri, 1966)] с размерами «бродяжек» Ichthyophthirius, для которого МЛД известна. Минимальные летальные дозы УФ-излучения для некоторых микроорганизмов (преимущественно паразитических) приведены в табл. 4.1.
Даже при оптимальных условиях УФ-лучи, по-видимому, неспособны проникать в толщу воды на глубину, превышающую 5 см. Проникающая способность еще больше уменьшается, если в воде присутствуют ВОВ, РОВ, а также неорганические ионы. Другими словами, в воде с высоким содержанием органических веществ или очень мутной УФ-облучение неэффективно. При одинаковых дозах ультрафиолетовое облучение более эффективно в пресной воде, чем в солоноватой и морской, где содержится много неорганических ионов.
Устройство стерилизаторов. Обзор конструкций стерилизаторов содержится в работе Уитона (Wheaton, 1977).
Существует два основных типа УФ-стерилизаторов: поверхностные и погружные. Поверхностный стерилизатор состоит из батареи УФ-ламп с отражателями, укрепленной на высоте 10-20 см над мелким лотком, через который протекает вода. Лоток необходим, чтобы уменьшить толщину слоя облучаемой воды. Более надежны погружные стерилизаторы. Их параметры лучше поддаются расчету, кроме того, их можно устанавливать в любом месте водоочистной системы простым подсоединением в линию водоподачи или сброса. В некоторых стерилизаторах УФ-лампы заключены в водонепроницаемый корпус из кварцевого стекла, который создает вокруг лампы изолирующий слой воздуха, предохраняющий ее от остывания в воде и обеспечивающий работу лампы при оптимальной температуре (40,5 С). Если кварцевая оболочка отсутствует и лампа работает при температуре ниже оптимальной, эффективность облучения заметно снижается. На рис. 4.2 показано устройство типичного погружного стерилизатора. Вода поступает в стерилизатор через патрубок 1, протекает с определенной скоростью мимо УФ-лампы и по выводной трубе снова возвращается в аквариум.
Для погружных стерилизаторов необходимо два дополнительных приспособления: счетчик интенсивности излучения и устройство для протирки кварцевого корпуса.
Со временем эффективность работы УФ-лампы снижается. Специальная щетка необходима для удаления биологической пленки, образующейся на внешней поверхности корпуса и снижающей проникающую способность ультрафиолетовых лучей.
УФ-стерилизаторы должны обеспечивать максимальную интенсивность излучения (1,0*10в 6й степени мкВт с/см2) при расходе воды не ниже полного объема системы за 24ч. Решающее значение имеет продолжительность контакта, эффективная доза радиации может быть удвоена путем уменьшения расхода воды, протекающей через стерилизатор, на половину.
В отрегулированной системе обработка воды трех-атомным кислородом или озоном снижает число свободноплавающих микроорганизмов.
Примечание: Озон - состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях - голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.
При обычных дозах и непродолжительном контакте озонирование не снижает содержание растворенных органических веществ путем прямого окисления до СО2, как это принято думать и не переводит общий аммоний в более окисленные соединения. К озонированию чувствительны органические соединения с двойными углеродными связями (С=С). Функциональные группы типов - SH; S+; — NH2, — ОН и — СНО также подвержены действию озона. При озонировании одни органические соединения переходят в другие, и в результате содержание общего органического углерода (окисляемость) в воде не изменяется (Farooq et а1., 1977 а; Nebel et al., 1973). После озонирования морской воды в аквариуме «Мистик Маринлайф» не наблюдалось снижения содержания общего органического углерода по сравнению с исходным (6,0 мг/л).
Хьюберс и др. (Huibers et al., 1969), Маккарти и Смит (McCarthy and Smitki, 1974) и Небел и др. (Nebel et al., 1973) пришли к выводу, что озонирование не является нитрификационным процессом. Сингер и Зилли (Singer and Zilli, 1975) показали, что в пресной воде с рН от 7,0 до 9,0 слабая кинетика процесса препятствует переходу значительного количества аммония в нитраты. Сходный вывод можно сделать и для морской воды, хотя Хонн и Чавин (Нопп and Chavin, 1976) сообщали, что после озонирования в замкнутой морской системе содержание аммония и нитритов снизилось, а нитратов — возросло. Таким образом, включение озонатора в систему сразу после биологического фильтра обеспечивало непосредственное окисление аммония и нитритов. Однако прямых кинетических исследований не проводилось, и поэтому говорить о прямом окислении неорганического азота при озонировании морской воды, преждевременно.
Факторы, влияющие на эффективность дезинфекции. Эффективность озона как дезинфицирующего средства зависит в основном от времени контакта и остаточной концентрации недиссоциированного О3. Поддерживать остаточное содержание озона на одном уровне трудно, поскольку он очень нестабилен, а его окислительная способность часто расходуется не только на живые микроорганизмы, но и на другие субстанции. Таким образом, эффективность поражения микробов определяется степенью диссоциации О3 после попадания его в контактную камеру.
Содержание РОВ, ВОВ (в том числе микроорганизмы), рН и ионная сила воды влияют на потребление озона в аквариумной воде и уменьшают количество Оз, необходимое для дезинфекции. Увеличение какого-либо из этих параметров приводит к соответствующему увеличению порогового уровня О3, необходимого для дезинфекции. На эффективность дезинфекции непосредственное влияние оказывает также температура воды. Фарук и др. (Farooq et al., 1977) показали, что при повышенной температуре число пораженных микроорганизмов возрастает. Из их опыта (рис. 4.3) следует, что при постоянном уровне остаточного озона (0,57 мг/л) эффективность дезинфекции воды увеличивалась с возрастанием температуры (9, 20, 30, 37С).
С возрастанием рН диссоциация молекул озона ускоряется, однако зависимость эффективности дезинфекции воды от рН носит непрямой характер (Farooq et al., 1977а) и число пораженных микроорганизмов больше зависит от уровня остаточного озона, чем от рН. На рис. 4.4 показано, что выживаемость дрожжевого грибка Mycobacterium fortuitum при постоянном содержании остаточного озона и четырех уровнях рН была одинаковой.
Содержание в воде РОВ и ВОВ увеличивает потребление озона в воде и тем самым ограничивает эффективность дезинфекции. Когда в воде одновременно присутствуют и растворенные органические вещества, и микроорганизмы, озон в первую очередь действует на POB (Hoigne and Bader, 1976). Это частично объясняется большей концентрацией органических молекул по сравнению с микроорганизмами и тем, что продукты диссоциации озона (свободные радикалы) легче взаимодействуют с РОВ, чем недиссоциированный О3 (Hoigne and Bader, 1976). Фарук и др, (1977 а) обнаружили, что эффективность дезинфекции во многом зависела и концентрации клеток микроорганизмов: чем выше концентрация, тем эффективность ниже. Микроорганизмы в этом случае следует рассматривать, как составную часть ВОВ, а ВОВ в любых формах снижает дезинфицирующую способность озона.
Увеличение ионной силы аквариумной воды повышает потребность воды в озоне, поскольку при этом возрастает число способных окисляться неорганических ионов. Из-за высокого содержания неорганических солей поддерживать концентрацию остаточного озона на определенном уровне в морской воде гораздо сложнее, чем в пресной.
Устройство озонаторов. Отсутствие необходимой информации затрудняет создание озонаторов для аквариумных систем. Некоторые сведения можно почерпнуть из технической литературы по промышленному обеззараживанию воды, но только в том случае, если в опытах не использовалась дистиллированная вода. Работы по дезинфекции морской воды озоном малочисленны, а дезинфекция озоном аквариумной воды вообще не рассматривалась. Хонн и другие (Honn et al., 1976) описывают конструкцию озонатора для замкнутых аквариумных систем, работающего по принципу тихого разряда, но не приводят сведений по дезинфекции воды. Восприимчивость патогенных организмов к озонированию систематически не изучалась. Почти во всех случаях объектами исследований были бактерии, а простейшие и другие инфекционные и паразитические организмы не рассматривались. Конрад и др. (Conrad et al., 1975) сообщили, что после озонирования число бактерий Flexibacter columnaris в воде пресноводного лососевого питомника уменьшилось, однако применявшиеся дозы и продолжительность контакта не указаны. Ведемейер и Нельсон (Wedemeyer and Nelson, 1977) описали действие озонированной воды на две патогенные для рыб формы бактерий Aerornonas salmonicida и возбудителя эрозии рта (болезнь «красный рот»). Оба вида представляют опасность на лососевых хозяйствах. В дистиллированной воде с добавлением фосфатного буфера, где не происходило побочного потребления озона, бактерии, вызывающие эрозию рта, полностью погибали спустя 0,5 мин при остаточном содержании озона 0,01 мг/л, а А. salmonicida — спустя 10 мин. Чтобы обеспечить 100%-ную гибель А. salmonicida за 0,5 мин потребовалась доза остаточного озона 0,04 мг/л. Для полного уничтожения обоих видов бактерий в течение 10 мин в озерной воде (мягкой и жесткой) потребовалась значительно большая доза остаточного озона (90 мг/л). Как и следовало ожидать, в жесткой воде дезинфекция затруднена.
По концентрации бактерий и ВОВ аквариумную воду при высокой плотности посадки рыбы можно сравнить с водой низкого качества из естественных поверхностных источников, а при низкой плотности - с поверхностной водой высокого качества. Для дезинфекции таких вод Маккарти и Смит (McCarthy and Smith, 1974) рекомендовали дозу озона 0,5 — 4,0 мг/л при продолжительности контакта 5 - 10 мин. До получения новых данных эти значения можно принять за основу при обработке пресноводных, солоноватоводных и морских аквариумов. При этом следует иметь в виду, что паразитические простейшие, по-видимому более устойчивы к озонированию по сравнению с мелкими вирусами и бактериями.
Для дезинфекции аквариумной воды применяют озонаторы двух типов: ультрафиолетовые и тихого (электрического) разряда. Озонатор второго типа показан на рис. 4.5. Ультрафиолетовые озонаторы применяют, когда требуется невысокая концентрация озона, например для домашних аквариумов. Если в качестве исходного газа используют кислород, то в зависимости от размеров ультрафиолетовые озонаторы обеспечивают выход озона от 1 до 10 мг/л (1,0 мг/ч). Если в качестве сырья используется атмосферный воздух, то выход озона примерно на 50% меньше. В зависимости от конструкции озонатора поток исходного газа проходит непосредственно мимо УФ-лампы или попадает под ее кварцевый корпус. Конечный выход озона в ультрафиолетовых озонаторах зависит от общего эффективного излучения, испускаемого в диапазоне 1000 — 2000 А, который в свою очередь определяется устройством УФ-лампы, ее общей поверхностью излучения, силой тока, видом исходного газа (кислород или атмосферный воздух), давлением газа под корпусом лампы или в разрядной камере, температурой исходного газа.
Озонаторы тихого электрического разряда применяются в больших демонстрационных аквариумах или на рыбоводных хозяйствах, т. е. там, где потребность в озоне велика. Тихоразрядные озонаторы могут производить до 6% озона на 1 Вт энергии, однако наиболее экономичный выход получается при выработке 1 - 3% озона на 1 Вт. Принцип работы озонатора тихого разряда состоит в приложении переменного напряжения к двум электродам, разделенным изолятором или диэлектриком в разрядной камере (рис. 4.6). Диэлектрик необходим для образования озона, в противном случае между электродами просто возникнет искра или дуга. Кроме того, направление тока должно изменяться, поскольку проникнуть через диэлектрик электроны не могут. В течение половины цикла переменного тока изоляционный материал собирает электрические заряды на своей поверхности, а при перемене полярности испускает их. Во время работы озонатора в разрядной камере образуется рассеянное свечение или корона.
Электроды обычно изготовляют из нержавеющей стали или алюминия, в качестве диэлектрика применяют боросиликатное стекло. Один из электродов соприкасается со стеклянным диэлектриком, а разрядная камера находится между диэлектриком и вторым электродом (см. рис. 4.6). При напряжении менее 1500В высота разрядной камеры обычно составляет 1 - 3 мм. Большая часть поступающей электрической энергии в озонаторах тихого разряда превращается в тепловую, поэтому необходимо предусмотреть приспособление для охлаждения подаваемого газа, если его напор недостаточно велик. Однако следует помнить, что слишком большая подача воздуха снижает эффективность процесса образования озона.
Выход озона в озонаторах тихого разряда зависит от концентрации кислорода в поступающем газе, температуры газа, величины его напора, максимального напряжения, частоты тока, емкости разрядной камеры, давления газа в разрядной камере и емкости диэлектрика. При прочих равных условиях для озонатора такой конструкции выход озона является функцией плотности тока (Rosen, 1973).
В литературе по крупным очистным сооружениям содержатся упоминавшиеся в начале этой главы рекомендации по оптимальным дозам озона и продолжительности контакта, однако эти данные неприменимы к малым объемам воды по двум причинам. Во-первых, количества О3, вырабатываемого ультрафиолетовыми озонаторами, достаточно для дезинфекции лишь очень небольших объемов воды. Во-вторых, существующие конструкции озонаторов непригодны для малых аквариумов. Типичным примером являются пеноотделительные колонки (см. рис. 3.10 и 3.11), в которые вместо воздуха подается озонированная газовая смесь. Впервые их устройство описал Сандер (Sander, 1967), который рекомендовал использовать колонки в качестве озонаторов, но оказалось, что они неспособны обеспечить необходимый контакт газа с водой даже в течение рекомендованных 5 мин. Более того, если озона вырабатывается достаточно для обезвреживания микроорганизмов, существует опасность, что избыток его окажется опасным для рыб и беспозвоночных в аквариуме. Тот факт, что животные в небольших аквариумах редко поражаются озоном, свидетельствует о неэффективности озонаторов и ненадежности обработки воды малыми дозами озона.
По сравнению с озонированием УФ-облучение более надежно. Интенсивность излучения легче контролировать, чем концентрацию озона в растворе. Приборы для стерилизации воды ультрафиолетовыми лучами, как плавило, более экономичны, и их можно отрегулировать с большей точностью. Озонаторы значительно менее надежны, большая часть электрической энергии, предназначенной для получения озона, в тихоразрядных конструкциях теряется в виде тепла, что заметно увеличивает расходы на обработку воды в больших замкнутых системах. Кроме того, фактическую концентрацию озона необходимо определять in situ лабораторными методами. Большинство промышленных установок снабжено расходомерами и счетчиками для определения концентрации озона, нс, поскольку выход озона зависит от многих факторов, эти приборы не всегда надежны. Как показал лабораторный анализ, одна из установок, испытывавшаяся в аквариуме «Мистик Маринлайф», фактически производила только 30% указанного на счетчике количества озона.
Ультрафиолетовое облучение. Продолжительность работы УФ-лампы зависит как от долговечности электрода и степени соляризации, так и от обоих факторов вместе. Долговечность электродов обратно пропорциональна частоте включений и выключений лампы. Соляризация - это медленное потемнение лампового стекла под действием продолжительного УФ-облучения. Часть ртути, которая, испаряясь, конденсируется на стекле, задерживает всевозрастающее количество излучаемой энергии. При длительной эксплуатации лампа в обычном смысле не перегорает, не тускнеет и не мерцает. Эффект соляризации можно установить только по показаниям счетчика интенсивности излучения. Если интенсивность излучения снизилась на 25%, это означает, что лампа выработала свой ресурс и ее необходимо заменить. Обычно это происходит спустя год непрерывной работы лампы или через 8000 ч.
Остается установить, действительно ли УФ-стерилизаторы снижают смертность рыбы в аквариуме. Хералд и др. (Herald et al., 1970) сообщили, что стерилизатор погружного типа, установленный в аквариуме «Стейнхар» в Сан-Франциско, уменьшал численность свободноплавающих микроорганизмов на 98%. Несмотря на это, смертность рыбы оставалась на прежнем уровне (2,5% численности популяции ежемесячно). Вопрос фактически заключается в следующем: какое минимальное количество микроорганизмов способно вызвать инфекцию. Ответа пока нет. На рыбоводных хозяйствах стерилизаторы, безусловно, снижают смертность рыбы (Bullоck and Stuckey, 1977; Hoffman, 1975; Sanders et al., 1972). Условия содержания рыбы на рыбоводных хозяйствах и в замкнутых аквариумных системах значительно различаются. Высокие плотности посадки способствуют распространению заболеваний, а присутствие нескольких больных особей увеличивает вероятность вспышки эпизоотии.
Озонирование. Очень важно, чтобы газ, подаваемый в озонатор, был предварительно высушен. Осушители обычно устанавливают за холодильниками, охлаждающими подаваемый газ. В результате охлаждения из газа удаляется часть влаги, что повышает эффективность осушителей, и снижается температура в разрядной камере, что замедляет процесс диссоциации образующихся молекул озона. Присутствие в подаваемом газе воды в количестве всего 0,020,03 мг/л заметно снижает выход озона (О'Donovan, 1965). В качестве осушителя обычно используют силикагель или хлорид кальция (Call). По мере насыщения эти материалы можно восстановить, пропуская через них горячий воздух в направлении, обратном току поступающего газа.
В больших оборотных системах, обработанных соответствующими дозами озона, перед подачей озонированной воды в аквариумы ее необходимо аэрировать в специальной камере, чтобы удалить из воды избыток озона и кислорода. Остаточный озон токсичен для рыб и беспозвоночных, а кислород, образующийся при диссоциации озона, может перенасытить воду и вызвать газопузырьковую болезнь.
Как и в случае с УФ-облучением, сомнительно, чтобы обработка аквариумной воды озоном существенно уменьшала возможность заражения гидробионтов. Необходимость дальнейшего изучения данного вопроса очевидна.
Газообмен в том смысле, в каком этот термин употребляется в данной книге, означает проникновение газов из воздушной среды в водную и наоборот. Этот процесс в аквариумах интенсифицируется с помощью аэрации. Под дыханием будем понимать физиологический обмен газов между водными организмами и внешней средой.
Для поддержания жизни животным и аэробным бактериям необходим кислород, который подается в аквариум путем аэрации. Поступление кислорода из атмосферы в воду зависит от газообмена между поверхностью воды и атмосферным воздухом, а также между поверхностью воздушных пузырьков и водой. В процессе аэрации разрушается целость водной поверхности, слои воды, бедные кислородом, выносятся на границу раздела сред вода — воздух. Поскольку содержание кислорода в воздухе выше, он по градиенту концентрации переходит в раствор. То же самое происходит, когда распыленные в толще воды пузырьки воздуха поднимаются к поверхности. Концентрация кислорода в воздушных пузырьках выше, чем в окружающей воде, и он путем диффузии переходит в раствор. Эффективность постоянной аэрации выше, чем периодической, особенно когда распыляемые пузырьки воздуха малы. Чем мельче пузырьки, тем больше общая поверхность газообмена.
Перемешивание поверхностных слоев позволяет удалять свободную углекислоту из раствора путем перемещения насыщенных СО2 слоев на границу раздела воды и воздуха. Снижение парциального давления свободной углекислоты в растворе позволяет поддерживать ее уровень в строгом соответствии с концентрацией СОН в атмосфере.
Эрлифт. Перемешивание поверхностных слоев воды и насыщение ее пузырьками воздуха осуществляются с помощью эрлифта. Основной частью эрлифтного насоса (или просто эрлифта) является вертикальная труба, которую называют подъемной. Нижняя часть трубы выводится под плату биологического фильтра. Наибольший дефицит кислорода ощущается под фильтровальной платой, поскольку там собирается вода, прошедшая через гравийный слой, населенный многочисленными аэробными бактериями. Свободный конец подъемной трубы проходит через толщу воды и несколько возвышается над ее поверхностью (рис. 5.1).
Эрлифт — наиболее надежное устройство для пропускания воды через биологический фильтр. Преимущества эрлифта перед механическим насосом состоят в более низкой стоимости, легкости обслуживания (отсутствуют движущиеся части), простоте установки, портативности, эрлифт не забивается илом, просто устроен, он гораздо эффективнее центробежного насоса при работе в глубока погруженном состоянии, наконец, на эрлифте легко отрегулировать расход воды. Кроме того, эрлифт имеет многоцелевое назначение.
Принцип работы эрлифта изложен ниже. Уровни воды внутри и снаружи погруженной вертикально в воду подъемной трубы выравниваются. Подаваемый в нижний конец трубы воздух поднимается в виде многочисленных пузырьков. Смешиваясь с водой, они образуют водовоздушную смесь, которая, естественно, легче воды.
Водовоздушная смесь внутри трубы легче воды снаружи, следовательно, равновесие нарушается, и тяжелые порции воды из-под фильтра поступают в нижний конец трубы эрлифта. До тех пор пока пропускается воздух, равновесия не наступает, и водовоздушная смесь выливается через верхний конец трубы.
Главный фактор, влияющий на эффективность работы эрлифта - степень погружения подъемной трубы: с уменьшением глубины погружения расход воздуха возрастает. Максимальная эффективность достигается при 100%-ном погружении, т. е. когда верхний конец подъемной трубы находится под водой. Минимально допустимая степень погружения эрлифта 80%. Глубину погружения подводной части трубы легко рассчитать (рис. 5.2). Если расстояние от места воздухоподачи до водовытока (3 - 1) равно 50 см, а общая высота подъема воды (2 - 1) -10 см, то
Расход воды в эрлифте, расчитанный по уравнению (10), как функция длины и диаметра прдъемной трубы при трех степенях погружения аэрлифта приведена в таб. 5.1.
Как правило, при увеличении диаметра подъемной трубы вдвое ее общая производительность в 5,6 раза.
Если объем подаваемого воздуха превышает производительность эрлифта, эффективность его работы снижается. Об этом свидетельствует булькающий звук, издаваемый выходящим из аэрлифта воздухом. Устранить эти неполадки можно, уменьшив подачу воздуха из компрессора. Вода из аэрлифта должна выходить ровно и плавно, если она бьет струей, либо количество подаваемого воздуха для эрлифта данного диаметра велико и большая часть воздуха, пробулькивая через воду, уходит в атмосферу, либо труба эрлифта недостаточно погружена в воду.
Как уже отмечалось, газообмен происходит эффективнее, если подаваемый воздух распыляется. В небольших аквариумах, где диаметр подъемной трубы эрлифта не превышает 2,5 см, в качестве диффузоров применяют пористые керамические насадки. В крупных эрлифтах в качестве распылителя используют перфорированные пластинки, которые укрепляют над патрубком подачи воздуха.
Устройство эрлифтов. В аквариумах обычно применяют эрлифты двух основных конструкций: с центральной подачей воздуха (воздухоподающий шланг расположен внутри подъемной трубы эрлифта) и с боковой подачей воздуха (воздухоподающий шланг находится вне трубы эрлифта). Обе схемы пригодны для различных условий работы. На рис. 5.3 представлено по два варианта каждого типа.
Несмотря на многочисленные исследования работы эрлифтов, приемлемое уравнение, связывающее основные переменные, до сих пор не разработано. Тем не менее, необходимая информация в большинстве случаев доступна. Кастро и др. (Castro et а1., 1975) выполнили расчеты для эрлифтов небольшой длины и малого диаметра. Немет (Nemet, 1961) вывел уравнение для расчета эрлифтов, основываясь на характеристиках большого числа устройств разной длины, диаметра и степени погружения. Применительно к аэрирующим эрлифтам уравнение Немета можно представить в следующем виде:
Кастро (Castro, 1976) получил около 140 групп данных для разных диапазонов L, S и D, пригодных для расчетов эрлифтов в рыбаводых системах. Иглтон (Eagleton, 1978) подставил данные Кастро в уравнение Немета (Nemet, 1961). Зависимость расхода воды от диаметра, по данным Кастро, оказывается более точной, если показатель степени у D равен 2,2, а не 2,5, как у Немета. Уравнение (10), построенное на основе линейной репрессии, довольно точно соответствует данным Кастро, хотя не исключена возможность составления и более правильного уравнения.
Q = (0,758S3/2 L1/3 + 0,01196) D2,2. (10)
Данные Кастро (Castro, 1976; Castro et аl., 1975), использованные для составления уравнения (10), относились к эрлифтам диаметром 1,7 — 7,8 см, длиной 60-З00 см и степенью погружения 60-100%.
Параметры эрлифтов, полученные Кастро, представляют больший интерес для аквариумистов, так как Немет использовал данные из разных источников, в том числе характеристики эрлифтов, применяемых для добычи нефти из скважин. Если расчеты, приведенные в табл. 5.1, повторить с использованием уравнения (9), обнаружится, что расход воды, рассчитанный по Немету, для эрлифтов диаметром 1 — 2 см, будет меньше, а для систем диаметром 6 — 8 см больше, чем при расчетах по формуле Кастро. Для эрлифтов диаметром 3-4 см расчеты расхода воды по обоим уравнениям совпадают. При использовании уравнения (10) рекомендуется предусмотреть 25%-ный запас (Eagleton, 1978). Иными словами, параметры эрлифта (длина, степень погружения) следует выбирать таким образом, чтобы рассчитанный расход воды превышал требуемый на 25%. Этот запас служит для поддержания оптимального расхода воды, а также обеспечивает устойчивую работу эрлифта при максимальном расходе как у нижнего, так и у верхнего концов подъемной трубы. Ниже приведен пример расчета эрлифта.
Рассчитать параметры эрлифта для аквариума глубиной 90 см и площадью поверхности 3 м2.
Определим норму расхода воды с учетом того, что на каждый квадратный метр поверхности требуется 40 л/мин (что соответствует 0,7*10 в -3степени м/с). Отсюда
3,0м2* 40л см2* мин) = 120 л/мин+25% = 150 л/мин
2. Выберем степень погружения эрлифта (например, 0,9). По табл. 5.1 находим диаметр трубы эрлифта, который сможет обеспечить найденный выше расход воды. Поскольку S=0,9, а L равно отношению глубины к степени погружения, т. е. 90/0,9=100см, D=6 см. Диаметр эрлифта можно определить непосредственно из уравнения (10), но обычно в этом нет необходимости.
3. Рассчитываем отношение длины трубы к ее диаметру (100/6= 17). С помощью номограммы (рис. 5.4) находим объемное отношение (вода/воздух) для погруженного на 90% эрлифта.
4. Поскольку объем воды (V H2O) равен 150 л, а 0,38=V H2O/Vвоздуха, то объем подаваемого воздуха Vвоздуха = 150/0,38=400 л/мин.
Растворимость кислорода. Парциальное давление газа в атмосферном воздухе прямо пропорционально занимаемому им объему. В воде зависимость между объемом газа в растворе и его парциальным давлением определяется его растворимостью, т.е. способностью взаимодействовать с водой. Кислород обладает средней растворимостью: он примерно в 28 раз менее растворим, чем СО2 и в 2 раза более, чем азот.
Более всего на растворимость кислорода влияют температура воды и ее соленость. Температура воды и растворимость кислорода связаны обратной зависимостью.
По мере возрастания температуры способность воды удерживать кислород снижается (см. табл. 9.4). Растворимость кислорода и соленость находятся также в обратной зависимости. Увеличение солености ведет к уменьшению содержания растворенного в воде кислорода, поэтому при одинаковых температуре и объеме в морской воде содержится меньше кислорода, чем в пресной (см. табл. 9.4).
Расход воды или объем воды, циркулирующей в аквариуме, определяется работой эрлифта. Постоянный расход воды 0,7*10 в -3 степени м/с поддерживает уровень кислорода в пределах насыщения при любых температурах и предотвращает возможность возникновения дефицита кислорода. Поддержание оптимального расхода воды особенно важно в тепловодных системах, где животные часто более требовательно к кислороду. Ситуация осложняется тем, что при повышенных температурах кислород хуже растворяется. Следует помнить, что фильтровальный слой оказывает значительное влияние на БПК и конкурирует с животными за кислород.
Вода - трудная для дыхания среда. При насыщении она содержит гораздо меньше кислорода, чем воздух, и во много раз больше углекислого газа. Это плотная, вязкая субстанция и водным животным приходится прикладывать много усилий, чтобы извлечь необходимый для жизни кислород.
B процессе дыхания извлеченный из внешней среды кислород транспортируется по кровеносной системе к клеткам тканей. Одновременно конечные продукты обмена и углекислый газ поступают в кровь и выводятся в окружающую среду. Таким образом, термин «дыхание» относится как к целому организму, так и к отдельной клетке. Механический процесс, посредством которого осуществляется дыхание, называется вентиляцией. Интенсивность вентиляции у водных животных непосредственно зависит от концентрации растворенного в воде кислорода (Dejeurs et а1., 1977).
Эффективность извлечения кислорода из водной среды зависит от функционирования дыхательных пигментов животных. Одним из наиболее известных дыхательных пигментов является гемоглобин. Химическая связь между кислородом и гемоглобином в упрощенной форме может быть представлена как
Hb + O2--><--HbO2.
(реакция12)
При высоком содержании в воде кислорода гемоглобин соединяется с ним с образованием оксигемоглобина (НЬ02), и реакция идет в правую сторону. При низкой концентрации О2 кислородные молекулы отщепляются, и реакция идет в обратном направлении. При снижении концентрации О2 до нуля гемоглобин теряет все молекулы кислорода. Когда парциальное давление кислорода в крови равно парциальному давлению его в воде, количество кислорода, которое связывается кровью при данном парциальном давлении 02, может быть изображено в виде кривой связывания кислорода. Кривые связывания кислорода для трех видов рыб, обитающих в Северной Атлантике, приведены на рис. 5.5. Из графика видно, что кровь устричной рыбы-жабы (Opsanus tau) насыщается при более низком парциальном давлении кислорода, чем кровь атлантической макрели (Scomber scombrus). Кислород из крови макрели легко переходит в ткани тела, вместе с тем кровь рыбы-жабы имеет большее сродство к кислороду и неохотно отдает О2 в ткани. Кривая связывания кислорода у ската занимает промежуточное положение между кривыми для макрели и рыбы-жабы.
На сродство гемоглобина к кислороду влияет несколько факторов, наиболее важными из которых являются температура и свободная углекислота. Их действие осложняется различными физиологическими потребностями и уровнем устойчивости разных видов, а также возрастными и размерными различиями между животными одного вида, поэтому положения, изложенные в следующем разделе носят скорее общий, чем частный, характер.
Свободная углекислота. Как видно из рис. 7.1, количество свободной СО2 в растворе зависит от рН. Если рН снижается, концентрация СО2 возрастает. Свободная углекислота образуется в воде в результате диссоциации бикарбонатных ионов. Это явление подробно будет рассмотрено в главе 7. Присутствие в крови свободной углекислоты оказывает заметное влияние на форму и положение кривой связывания кислорода. В процессе жизнедеятельности клетки по мере выделения ею в кровь свободной углекислоты возрастает общая кислотнoсть крови. По мере возрастания содержания СО2 в крови сродство дыхательных пигментов к кислороду уменьшается, реакция (12) идет влево, кислород переходит в ткани гораздо легче, чем это могло быть при пониженной кислотности и сравнимом парциальном давлении кислорода. В результате кривая связывания кислорода смещается вправо. Это смещение называют эффектом Бора. Холоднокровные (пойкилотермные) животные по разному реагируют на эффект Бора. У многих беспозвоночных он вообще не проявляется. Среди позвоночных Ленфант и Йохансен (Lenfant and Johansen, 1966) не обнаружили эффекта Бора у тихоокеанской собачьей акулы Squalus acanthias. Однако известно, что у многих других видов рыб при повышении в крови содержания СО2 этот эффект проявляется достаточно заметно (Ваsu, 1959; Black et al., 1954; Eddy et al., 1977; $аИгап and Gibson, 1976).
Из-за того что гемоглобин способен связывать большое количество СО2, в крови некоторых рыб происходит катастрофическое снижение концентрации О2. В таких случаях кривая связывания кислорода настолько отклоняется вправо, что выходит за допустимые пределы; животные начинают задыхаться даже в насыщенной кислородом воде. Это явление получило название «эффект Рута» (Root, 1931) (рис. 5.6). Эффект Рута по сути является крайней степенью эффекта Бора, поэтому многие исследователи не делают между ними различия.
Бейнс (Baines, 1975) и Хоар (Hoar, 1975) заметили, что зависимость между содержанием СО2 и способностью крови связывать кислород опрделается экологической обстановкой и способностью животного корректировать поступление кислорода в ткани в соответствии с изменяющимися условиями внешней среды. У животных с ярко выраженным эффектом Бора гемоглобин имеет слабое сродство к кислороду, кривая связывания кислорода у них носит сигмоидный характер. Примером может служить кривая для макрели, показанная на рис. 5.5. У животных, кровь которых имеет высокое сродство к кислороду и поступление О2 в ткани затруднено, кривая связывания кислорода приобретает прямоугольную форму. Примером служит кривая для рыбы-жабы (см. рис. 5.5). Форма кривой связывания кислорода гемоглобином в определенной степени отражает образ жизни животного, общий уровень его активности, среду обитания. Многие стайные рыбы подобно макрели много перемещаются, высокоактивны. Ткани их тела должны легко насыщаться кислородом. Однако это не составляет проблемы, поскольку среда, в которой они обитают, насыщена растворенным кислородом. Рыба-жаба в отличие от макрели ведет малоподвижный сидячий образ жизни. Она обитает в прибрежных водах, где содержание свободной углекислоты иногда повышается, что часто сопровождается снижением концентрации растворенного кислорода. В таких условиях свойство крови удерживать большое количество кислорода является неоспоримым преимуществом рыбы-жабы.
Температура. Повышенная температура ослабляет связи между кислородом и гемоглобином, в результате чего реакция (12) сдвигается влево, а кривая связывания кислорода отклоняется вправо, так как гемоглобин легче отдает О2.
Повышение температуры среды обычно сопровождается увеличением интенсивности обменных процессов и потому смещение кривой вправо имеет ярко выраженное приспособительное значение, так как высокая интенсивность обменных процессов у водных животных вызывает усиленное потребление кислорода тканями тела.
Как правило, повышение температуры внешней среды на 10С приводит к увеличению потребления кислорода холоднокровными животными в 2 или 3 раза. Канунго и Проссер (Kanungo and Prosser, 1959) отмечали, что активное потребление кислорода серебряным карасем, содержавшимся при температуре 30С, было на 359% выше, чем у рыб, адаптированных к температуре 10С. Моррис (Morris, 1962) обнаружил, что у цихлиды Aequidens portalegrensis при повышении температуры потребление кислорода удваивалось. Фрай и Харт (Fry and Hart, 1948), Канунго и Проссер (Kanungo and Prоsser, 1959) и Уэллс (Wells, 1935) показали, что при промежуточных температурах адаптированные к холодной воде рыбы потребляли больше кислорода, чем рыбы, адаптированные к теплой воде. Канунго и Проссер обнаружили также, что если адаптированного к температуре 10 С карася поместить в воду температурой 20С, стандартное потребление им кислорода будет на 26%, а активное потребление на 10% больше, чем у рыбы, адаптированной при 20C и переведенной в воду температурой З0С.
Термальная устойчивость холоднокровных животных зависит от той температуры, при которой они жили ранее: устойчивость водных животных к колебаниям температуры уменьшается при низком содержании в воде кислорода (Weatherly, 1970). Более того, количество растворенного в воде кислорода влияет на скорость адаптации к новым температурным условиям. Например, Фрай (Fry, 1947) показал, что при перемещении американского сомика из воды температурой 20С в воду температурой 28С адаптация происходила в течение 24 ч при оптимальном содержании кислорода. При слишком низком содержании кислорода адаптация полностью прекращалась.
По мнению большинства специалистов, температурная адаптация - длительный процесс. Механизмы, регулирующие температурный предел, за которым наступает гибель, до сих пор до конца не выяснены, однако известно, что главную роль играют изменения в ферментативных системах (Somero and Hochachka, 1976). Бретт (Brett, 1956), Саундерс (Saunders, 1962), Шлипер (Sсhlieper, 1950) и Уэллс (Wells, 1935) показали, что полная температурная адаптация рыб происходит за несколько дней. Саундерс отмечал, что полная акклиматизация карпа (Cyprinus carpio) при повышении температуры воды с 32 до 36С происходит за 48 ч. Он рассчитал, что для нормальной акклиматизации скорость повышения температуры должна составлять 1С за 24 ч. Тайлер (Tyler, 1966) успешно применил эти нормативы при акклиматизации двух видов карповых рыб к повышенным температурам. При акклиматизации этих рыб к пониженным температурам скорость снижения температуры составляла 0,5С за 24 ч.
Для нормальной эксплуатации аквариума необходимо поддерживать содержание растворенного кислорода на уровне насыщения при любой температуре и солености, а также медленно адаптировать вновь посаженных животных к температуре воды в аквариуме.
Растворенный кислород. Минимальный расход воды в аквариуме любого типа должен составлять 0,7*10 в -3 степени м/с. Это позволяет поддерживать содержание кислорода в воде на уровне насыщения при любой температуре и солености. Концентрацию кислорода в воде можно определить по методу, описанному в разделе 9.5. Одновременно определяют температуру воды и соленость по табл. 9.4 сравнивают измеренное содержание кислорода с нормативным при полном насыщении. Если измеренное содержание О2 ниже нормативного при насыщении более, чем на 15%, следует увеличить расход воды и включить дополнительную аэрацию. Особенно важно поддерживать высокий уровень растворенного кислорода в теловодных морских аквариумах, где в воде с самого начала содержится мало О2.
Высокоактивных рыб и беспозвоночных, т. е. виды, чувствительные к эффекту Бора, следует содержать в воде со стабильным содержанием свободной углекислоты (определяемой оперативно, как и рН), при неизменных температуре и солености. Чтобы исключить возможное вредное влияние свободной углекислоты, рН в морских аквариумах не должен быть ниже 8,0. Пресноводные животные, как правило, более устойчивы к колебаниям рН, но и в пресноводных аквариумах рН должен быть не ниже 7.1. Вредные последствия эффекта Бора, вызванные температурными колебаниями, можно уменьшить постепенной адаптацией рыб к новой температуре воды. Впоследствии колебания температуры не должны превышать +- 2С.
Внезапное повышение температуры или содержания свободной углекислоты более опасно, чем такое же по величине снижение этих параметров, так как в первом случае возникает эффект Бора.
Эксплуатация эрлифта. Способ подачи в подъемную трубу воздуха особенно важен для низконапорных эрлифтов (Nemet, 1961). Если воздух подается через обычную трубку, образуются пузырьки воздуха разного размера. В воде такие пузырьки поднимаются с разной скоростью: крупные быстрее, мелкие медленнее. Когда такие разноразмерные пузырьки оказываются в подъемной трубе эрлифта и смешиваются с водой, эрлифт работает бурно, но непроизводительно. Более эффективное образование водовоздушной смеси происходит, когда воздух распыляется в виде мелких однородных пузырьков, поднимающихся к поверхности с одинаковой скоростью.
Кроме того, мелкие пузырьки обеспечивают более эффективный газообмен, так как их удельная поверхность значительно больше. Для обеспечения равномерного потока воды в малых эрлифтах и хорошего газообмена применяют стандартные диффузорные насадки, например из карборунда. В больших эрлифтах роль диффузора выполняет перфорированная пластинка, установленная над патрубком подачи воздуха.
Эрлифтные насосы работают в пульсирующем режиме даже в оптимальных условиях. По мере достижения оптимального расхода воды паузы между толчками уменьшаются и пульсация становится почти незаметной. Если воздух выходит из эрлифта заметными толчками, то это свидетельствует либо об избыточной подаче воздуха, либо о недостаточной степени погружения эрлифта.
Температурная адаптация. Даже кратковременные отклонения от привычной температуры изменяют потребление кислорода, вызывают кислотно-основный дисбаланс и изменения жидкостно-электролитической регуляции у водных животных (Crawshaw, 1977).
Акклиматизацию вновь отловленных животных следует начинать при той температуре, при которой они обитали в природе для предупреждения температурного шока. Как в теплой, так и в холодной воде даже незначительное повышение температуры может вызвать превышение максимальной интенсивности обменных процессов у животных. В зоне умеренного климата привычные температуры различаются по сезонам и, таким образом, оптимальная в один сезон температура может стать летальной спустя 6 мес. Например, большеротый окунь (Micropterus salmoides), отловленный зимой, редко выживает при пересадке его в аквариум с теплой водой. Для окуня, пойманного летом, такая процедура менее опасна, так как летняя температура воды в естественных водоемах значительно выше.
Рыбы, внезапно помещенные в воду с непривычной температурой, испытывают температурный шок, что определяется по общему для большинства видов поведению. Если новая температура выше привычной, то возрастает активность, теряется равновесие (бесцельные метания, всплывание к поверхности, движение в неестественном положении, усиление моторики плавников, зависание на месте с приподнятым хвостом), усиливается общая дыхательная активность, проявляющаяся в учащенном движении жаберных крышек (НоИ and Westman, 1966). Если рыба попадает в более холодную воду, она теряет равновесие, дыхательная активность усиливается, наблюдаются конвульсии и спазмы (Hoff and Westman, 1966).
Температурный шок - основная причина гибели водных животных при пересадке в аквариумы. Для уменьшения температурного шока Тайлер (Tyler, 1966) предложил опускать транспортные полиэтиленовые пакеты с рыбой в аквариум, с тем чтобы температура внутри и снаружи их уравнялась. Этим способом следует пользоваться с осторожностью, особенно если разница температур внутри пакета и в аквариуме значительна. Температура внутри пакета уравняется очень быстро, но интенсивность обменных процессов у рыб внутри пакета останется без изменения.
Описанный способ снижает потери рыбы, если она находится в хорошем состоянии. Если во время перевозки животные страдали от недостатка кислорода и повышенного содержания в воде аммония и СО2, то, оставаясь в этих неблагоприятных условиях еще какое-то время, они подвергаются значительно большей опасности.
Самым безопасным методом акклиматизации новых животных является создание в аквариуме тех температур, к которым они были адаптированы до поимки. В аквариуме животные должны содержаться в воде с привычной температурой, по крайней мере, неделю.
Бретт (Brett, 1970) показал, что рыбы легче адаптируются к повышенным по сравнению с привычными, чем к пониженным температурам. Скорость адаптации должна составлять 2С за 24 ч, если рыбу переводят в более теплую воду, и 1С за 24 ч, если ее помещают в более холодную по сравнению с привычной воду. Процесс акклиматизации должен сопровождаться усиленной аэрацией для обеспечения высокой концентрации кислорода в воде.
Морская вода отличается от пресной по количеству и набору растворенных солей, большей частью неорганических. Химические элементы, входящие в состав морской воды, приведены в табл. 6.1.
6.1. Солевой состав морской воды.
Суммарное содержание растворенных минеральных веществ в морской воде нормального ионного состава можно определить по ее солености, по весовой и объемной концентрации растворенного в воде хлора и, наконец, по ее плотности. Под соленостью обычно понимают общее количество минеральных веществ, растворенных в 1 кг морской воды, когда все карбонаты переведены в окислы, весь бром и йод замещены хлором, а органические вещества полностью окислены. Количество минерального вещества выражают в граммах, а соленость в граммах на килограмм или в тысячных долях. Соленость обозначают S и выражают в промилле (%о). При определении солености наряду с неорганическими ионами учитываются и органические вещества. Так, нормальная соленость морской воды 35%о учитывает все растворенные минеральные вещества: ионы, такие, как Na+ и Cl-, органические азот и фосфор, а также растительные пигменты, витамины и т.д.
Соленость трудно определить прямыми химическими методами, поэтому ее обычно рассчитывают через другую величину - весовую концентрацию хлора в воде (Сl%о). Вустер и др. (Тоофег et al., 1969) предложили следующую зависимость:
S%о=1,80655 (Сl%о). (13)
Содержание хлора рассчитывают по концентрации в образце морской воды галогенов, которую проще определить аналитически, чем соленость. Общепринятым методом является титрование образца воды нитратом серебра, в качестве индикатора применяют бихромат калия.
Весовая концентрация хлора выражается в граммах на килограмм образца морской воды, численно эта величина равна массе серебра (в граммах атомного веса), необходимой для связывания галогенов в 0,3285233 кг образца.
Ранее океанографы рассчитывали весовую концентрацию хлора в воде по общему содержанию хлора, брома и йода в граммах на килограмм морской воды, полагая, что бром и йод замещены хлором. Эта методика используется и сейчас при определении объемной концентрации хлора (см. ниже). При обычной эксплуатации аквариумов необходимость определении весовой концентрации хлора в воде, как правило, не возникает.
Концентрацию галогенов в морской воде иногда выражают через объемную концентрацию хлора, чаще так поступают европейские химики. По своей сути это то же содержание хлора в воде, но рассчитанное в граммах на 1 л (вместо r/кг). Поскольку объемные характеристики зависят от температуры, объемную концентрацию хлора в воде по этой методике определяют как общее количество хлора, брома, йода в граммах, приходящееся на 1 л морской воды при температуре 20С, полагая, что бром и йод замещены хлором. Объемная концентрация хлора в воде, рассчитанная по второму способу, на 2 - 3% больше весовой в одном и том же образце воды, поскольку 1 л морской воды весит больше 1 л пресной.
Термины «плотность» и «удельный вес» в обиходе аквариумистов употребляются равнозначно, однако на самом деле они - не синонимы. Термин «плотность» относится к массе единицы объема и выражается в граммах на миллилитр или на кубический сантиметр. Удельный вес - это отношение данного объема морской воды к аналогичному объему дистиллированной воды при 4С. Таким образом, удельный вес - величина безразмерная. Дистиллированную воду следует брать только при 4С, так как чистая вода достигает максимальной плотности именно при этой температуре.
Плотность морской воды зависит от ее температуры и солености. Третий фактор, влияющий на плотность,— давление — в аквариумной практике не учитывается. Даже в океанографических исследованиях влиянием давления пренебрегают, так как морская вода практически несжимаема. Соленость влияет на плотность, поскольку с увеличением числа ионов масса воды также увеличивается. Повышение солености, например на 1%о, сопровождается увеличением плотности воды приблизительно на 0,8%.
По сравнению с соленостью температура воды оказывает на плотность более заметное влияние. С повышением температуры плотность обычной морской воды (S=25%о и более) уменьшается (рис. 6.1). Другими словами, холодная вода плотнее теплой той же солености (соленость как зависимость веса от веса не подвержена температурному влиянию) . Если морскую воду разбавлять, она постепенно приобретает свойства пресной, например, при охлаждении ниже точки максимальной плотности солоноватая вода становится менее плотной.
Плотность - понятие, сложное для восприятия, и показатель, трудный для определения. Для точного определения плотности влияние температуры и солености должно быть учтено совместно и порознь (Williams, 1962). Соленость наиболее объективно характеризует концентрацию растворенных в морской воде солей. Показатели плотности и удельной массы воды (последняя требует поправки на температуру) менее надежны.
Обычно морская вода содержит 19% хлора, что соответствует солености 34,325%о. Нормальный удельный вес морской воды составляет 1,024 при солености 34%о и температуре 20С.
6.2. Функции элементов и потребность в них.
На организмы, обитающие в солоноватой и морской воде, оказывают влияние ионная сила раствора и состав среды. Многие элементы, присутствующие в растворе, жизненно необходимы для осуществления биохимических процессов. К основным функциям элементов в клетке Боувен (Bowen, 1966) относит электрохимическую, каталитическую и структурную. Если элемент является источником энергии для обмена, то он выполняет электрохимическую функцию. По-видимому, все необходимые элементы функционируют как активаторы ферментов и способствуют поддержанию определенного уровня биохимических реакций. В этом случае они осуществляют каталитические функции. Многие элементы незаменимы при синтезе белков и аминокислот. При этом они выполняют структурные функции и входят в состав конечного продукта.
Большинство, если не все из известных элементов присутствуют в природных водах. Многие не оказывают какого-либо заметного влияния и по всей видимости не столь важны. Эрнон и Стоут (Arnon and Stout, 1939) разработали шкалу значимости элемента Х для животного: (1) организм не способен расти и завершить жизненный цикл в отсутствии элемента Х; (2) элемент Х не может быть полностью заменен другими элементами и (3) Х непосредственно влияет на обменные процессы в организме.
Химические элементы поступают в организм животного из внешней среды двумя путями: путем диффузии или пассивного переноса и путем активного переноса.
Пассивный перенос, когда элемент из среды с высокой концентрацией (вода) переходит в менее концентрированную среду (межтканевая жидкость), не нуждается в объяснении. Активный перенос - это избирательное извлечение элемента из внешней среды часто против градиента концентрации *.
ОТ РЕДАКТОРА:
Процесс тесно коррелирует с температурой: повышение ее на 10С усиливает активный перенос почти на 100% (Bowen, 1966). Непосредственное влияние на процесс переноса оказывает концентрация растворенного в воде кислорода: при затруднении дыхания ионы особенно активно переносятся из среды в организм.
Вопрос о целесообразности добавления микроэлементов в замкнутые акваримные системы дебатировался годами. По-видимому, однозначного ответа не существует, однако несколько общих замечаний могут прояснить ситуацию. Обычно в аквариуме присутствуют различные элементы, причем содержание S, Р, N, Са, Мg, Na и многих других со временем заметно увеличивается в результате экскреции продуктов обмена веществ животных и растений. Численность бактерий со временем также возрастает до тех пор, пока не установится равновесие. По мере гибели и лизиса бактериальных клеток в воду поступает дополнительное количество элементов. Проблема фактически заключается не в истощении со временем каких-ro веществ, а в том, что, остаются ли они в биологически доступной форме, оказываясь в воде.
Если в аквариуме содержат растения или применяют методы физической очистки (активированный уголь или пеноотделительные колонки), содержание некоторых элементов может уменьшиться. Другие элементы могут окисляться при озонировании и, возможно, даже под действием УФ-излучения. Таким образом, состав морской воды в замкнутой системе со временем изменяется.
Обычно животные менее чувствительны к таким изменениям, чем растения. Животные получают питательные вещества, поедая растения и других животных, в то время как растения вынуждены извлекать питательные вещества прямо из воды, и их рост зависит от присутствия в доступной форме микроэлементов. Согласно О'Келли (О'Кепку, 1974) следующие элементы в неорганической форме (плюс С, Н и О) необходимы, по крайней мере, одному виду морских или пресноводных водорослей: N, Р, К, Mg, Са, S, Fe, Cu, Mn, Zn, Мо, Na, Со, V, Si, Cl, В, I. Из них N, Р, Mg, Fe, Cu, Mn, Zn, Мо необходимы всем водорослям и не могут быть даже частично заменены другими элементами. Вместе с тем такие ионы, как К, Sr, Са, до некоторой степени могут быть заменены элементами со сходным химическим зарядом (например, Са на Sr).
Можно возразить, что все эти микроэлементы, вероятно, присутствуют в достаточных количествах в качестве примесей к другим солям. Однако трудно утверждать, что этих примесей будет достаточно, чтобы обеспечить рост растений. Водоросли хорошо развиваются при регулярном внесении микроэлементов вместе с другими солями в процессе замены 10% старой воды раз в 2 недели. Обычно микроэлементы включают в состав искусственной морской воды.
6.3. Искусственная морская вода.
Фасованную готовую смесь для приготовления небольших объемов морской воды можно приобрести в зоомагазинах, где продают тропических рыб. Большие объемы готовят на месте по существующим рецептурам. Не рекомендуется использовать готовые смеси и рецепты, в состав которых не входят элементы, необходимые для роста растений, за исключением случаев, когда рост водорослей нежелателен. Применяемые смеси или рецептуры должны обеспечивать такое соотношение и концентрацию солей, чтобы искусственная вода была близка по составу к естественной морской, остальные требования носят побочный характер.
Приготовление небольших объемов искусственной морской воды. Большинство готовых смесей разводят обычной отстоявшейся водопроводной водой. Некоторые смеси требуют продолжительной аэрации (в течение нескольких часов), чтобы уравновесить рН. Другие, например «Инстент Оушен Синтетик Си Солтс», быстро достигают состояния равновесия, что позволяет сразу расселять животных. При использовании большинства смесей следует ежечасно контролировать рН и не пересаживать животных в искусственную воду до тех пор, пока рН не установится на уровне 8,1 - 8,3.
Из большого числа искусственных смесей наиболее пригодной для содержания животных и растений, как в лабораторных, так и в демонстрационных аквариумах оказалась «Инстент Оушен». Эта смесь успешно используется и в биологических исследованиях. Другие рецептуры тоже пригодны для аквариумов, однако ни одна другая смесь не прошла такой тщательной проверки, как «Инстент Оушен», что особенно ценно для научных исследований.
При использовании искусственных смесей необходимо точно соблюдать инструкцию. Искусственную морскую соль следует разводить в чистых емкостях из инертных материалов. Для этих целей пригодны пустые аквариумы, полиэтиленовые канистры и ведра с плотно закрывающимися крышками. Готовую смесь хранят закрытой для предотвращения испарения воды и увеличения концентрации раствора, а также попадания пыли и токсических веществ из атмосферы. Фирма «Аквариум Систем» выпускает специальный полипропиленовый резервуар-смеситель вместимостью около 400 л с насосом для перекачивания готового раствора в аквариум.
Приготовление больших объемов морской воды. Большие объемы искусственной морской воды приготовляют поэтапно в течение трех дней. Основные соли лучше растворять по очереди. Процесс ускоряется, если контейнер с солью постепенно заполнять чистой отстоявшейся водой, нагретой до 30С. Дополнительные соли растворяют на второй день, микродобавки — на третий. Если дополнительные соли и микродобавки растворять прежде основных компонентов, они могут выпасть в осадок. Чтобы все элементы равномерно распределились в растворе, прибегают к интенсивной аэрации. При соблюдении этих условий на четвертый день искусственная морская вода становится пригодной для содержания морских животных. Описанный выше процесс - усовершенствованный вариант опубликованной ранее методики Сегеди и Келли (Segedi and Kelley, 1964).
Оборудование для приготовления искусственной морской воды.
Установка для приготовления искусственной морской воды обычно состоит из приемной камеры, в которой растворяют соли и бака-накопителя для готового раствора (рис. 6.4). В приемную камеру через кран-смеситель подают горячую и холодную воду. Для контроля за температурой после смесителя устанавливают контактный термометр. Электрическая мешалка (на рисунке не показана), установленная на стенке камеры, ускоряет растворение солей, Для перемешивания воды бак смеситель снабжен мощным эрлифтом.
Вместо эрлифта можно установить механический насос. Эффективный эрлифт можно изготовить из обрезка полихлорвиниловой трубы (диаметр 10 см и более), у одного конца которой просверлено отверстие. Его диаметр должен быть достаточным для подключения воздухоподающего шланга, в качестве которого можно использовать гибкую пластмассовую трубку диаметром 0,95 см. Поскольку назначение эрлифта — просто перемешивать воду, распылительных насадок не требуется. Эрлифт можно либо наглухо закрепить в самой нижней точке бака-накопителя, где оседают нерастворившиеся соли, либо удерживать у дна каким-нибудь грузом. При заполнении бака верхний конец эрлифта необязательно должен выступать над водой.
В крупных морских системах хлористый натрий (главный компонент морской воды) удобнее добавлять не в кристаллической форме, а в виде концентрированного рассола. Его приготовляют на автоматической установке, разработанной фирмой «Интернейшнл Солт Компани». В больших количествах фасованная соль неудобна в обращении, кроме того, требуется много места для ее хранения. Рассыпную же соль, как и жидкость, легко перемещать, проще хранить, особенно если на территории имеется складское помещение. Кроме того, рассыпная соль дешевле фасованной. В процессе приготовления искусственной морской воды насыщенный солевой рассол проще перекачать в бак-накопитель, копирование NaC1 в этом случае осуществляется точнее и быстрее.
Схематически аппарат «Стерлинг Бриномат» показан на рис. 6.5. Доставляемая автомобилями рассыпная соль по трубопроводу пневматический загружается в приемный бункер. Водопроводная вода, поступающая в аппарат, протекает через нижнюю часть солевого слоя. По мере того как она опускается ко дну, крепость рассола возрастает. Непосредственно у дна он достигает полного насыщения, если бункер загружен полностью. Растворенная соль автоматически замещается сухой солью, поступающей из бункера. Важно отметить, что раствор достигает насыщения, не доходя до дна установки. Нижняя часть солевого пласта никогда не растворяется и служит механическим фильтром, с помощью которого из выходящего рассола удаляются нерастворимые механические примеси. По мере выхода готового раствора в бак-накопитель открывается поплавковый клапан, и в аппарат поступают новые порции свежей воды: приготовление рассола продолжается автоматически. В промышленных морских системах, чтобы учесть количество раствора, прошедшего в бак-накопитель, на аппарате устанавливают расходомер. Расходомеры из латуни предпочтительнее, поскольку они устойчивы к коррозии. Те микроскопические количества меди, которые могут попасть со стенок расходомера в воду, с токсикологической точки зрения абсолютно безвредны, кроме того, водопроводная вода, используемая для приготовления раствора, прежде чем попадает в смеситель, проходит долгий путь,по медным трубам. Для перекачки рассола или морской воды рекомендуются насосы из латуни, пластмассы или нержавеющей стали.
В табл. 6.2, приведен расход основных солей для приготовления 30240 л искусственной морской воды соленостью 35%о. Если хлорид натрия поступает из установки «Бриномат», то его требуется 2669л. Удельный вес приготовленного в «Бриномате» раствора зависит от степени заполнения бункера, Основные соли следует закупать фасованными по 45 кг в бумажные мешки, выстеленные полиэтиленом. Дополняющие соли и микродобавки закупают и хранят в плотно закупоренных стеклянных или полиэтиленовых банках.
Методика смешивания основных солей.
Методика растворения дополнительных солей.
Методика растворения микродобавок.
6.4. Практическое руководство.
Основные соли, используемые для приготовления искусственной морской воды, следует хранить в сухом помещении. Соли, оставшиеся после смешивания компонентов по формуле Сегеди — Келли, лучше хранить в полиэтиленовых банках с этикетками и плотно закрывающимися крышками. Дополнительные соли и микро-добавки также хранят в полиэтиленовых банках или стеклянных бюксах с плотно пригнанными крышками. Не следует открывать реактивов больше, чем их может понадобиться в течение 6 мес. Аналитические весы, применяемые для взвешивания, необходимо регулярно проверять.
Глава 7
Буферные системы аквариума
В результате химического взаимодействия между углекислотой, водой и неорганическими карбонатами в природной воде образуется система двуокиси углерода. Минеральные карбонаты выступают в системе в качестве буферов, препятствуя резким изменениям рН, которые могут представлять опасность для животных, растений и бактерий фильтровального слоя. Специфическое действие колебаний рН на физиологию водных животных изучено пока недостаточно, однако известно, что у рыб низкий рН воды влияет на потребление кислорода.
Систему двуокиси углерода определяют такие понятия, как буфер, щелочность, жесткость и рН. Буферами называют такие соединения, которые препятствуют изменению концентрации водородных ионов в воде. Основные из них - это карбонатные (СО3 во 2- степени) и бикарбонатные (НСОз-) ионы. Они нейтрализуют повышение и понижение содержания двуокиси углерода (СО2) и обеспечивают постоянство рН, предотвращая колебания концентрации водородных ионов. В системе двуокиси углерода с нормальным рН (7,1 - 7,8 в пресноводных аквариумах; 8,0 - 8,3 в солоноватоводных и морских) преобладающим буфером являются бикарбонатные ионы (НСОз-) (рис. 7.1).
Щелочность - это суммарное содержание отрицательных ионов, нейтрализующих ионы водорода, при добавлении в воду кислоты. Наиболее важными являются карбонатные и бикарбонатные ионы, хотя 10% буферной емкости морской воды обеспечивает борная кислота (Skirr0w, 1975). Щелочность обычно выражают в миллиэквивалентах на литр (мэкв./л). В морской воде она колеблется в пределах от 2,1 до 2,5 мэкв./л. Щелочность пресной воды меньше и более изменчива, поскольку в ней не содержится таких сильных буферов.
Жесткость - термин, применимый только к пресной воде. Жесткость характеризует общее содержание кальция и магния в воде и, как и щелочность, выражается в мэкв./л. Остальные катионы пресной воды не оказывают существенного влияния на жесткость: натрий и калий из-за их высокой растворимости, а другие элементы присутствуют в очень малом количестве. Пресную воду с низким содержанием Са и Ng считают мягкой.
рН характеризует концентрацию водородных ионов, зависящую от колебаний щелочности. рН выражают в 1/аН+. Среда с рН ниже 7 считается кислой, выше 7-щелочной. При рН, близком к 7, среда считается нейтральной (некислой и нещелочной). Когда в ходе реакции одним из продуктов диссоциации является Н+, раствор становится кислым, а рН уменьшается. Если в процессе диссоциации образуются ОН — -ионы, раствор — основный, а рН возрастает.
7.1. Карбонатные и бикарбонатные ионы.
Карбонатные и бикарбонатные ионы, присутствующие в аквариумной воде, могут быть результатом реакции свободной углекислоты с водой, взаимодействия неорганических карбонатов с водой и свободной углекислотой и микробиологических процессов.
Взаимодействие свободной углекислоты с водой. Свободная углекислота отличается высокой растворимостью. Она попадает в аквариумную воду из атмосферы через границу раздела вода — воздух, а также присутствует в растворе как побочный продукт обменных процессов. СО2 взаимодействует с водой с образованием угольной кислоты [уравнение (14)]. Угольная кислота затем диссоциирует с образованием ионов водорода и бикарбоната [уравнение (15)]. Бикарбонатные ионы диссоциируют далее с образованием карбонатных ионов и дополнительного количества ионов водорода [уравнение (16) ].
Эта многоступенчатая реакция очень чувствительна к рН и при повышении его уровня смещается вправо.
В жесткой пресной и морской воде, поскольку обе системы хорошо забуферены, преобладает диссоциация молекул угольной кислоты до бикарбонатов. Это следует из преобладания бикарбонатных ионов в диапазоне рН от 7,1 до 8,3 (см. рис. 7.1).
Взаимодействие неорганических карбонатов со свободной углекислотой (СО2) и водой. Другим источником карбонатных и бикарбонатных ионов в аквариумной воде служит взаимодействие неорганических карбонатов с углекислым газом и водой. В жесткой пресной и морской воде большая часть карбонатных соединений, которые способны повлиять на рН, связаны с кальцием и магнием. Эти карбонаты служат потенциальным резервом для образования бикарбонатных ионов, которые, диссоциируя, способны нейтрализовать любое изменение рН.
Если в ходе биологических окислительных процессов кислотность аквариумной воды возрастает, неорганические карбонаты переходят в раствор, реагируя со свободной углекислотой и водой,
В морской воде одного лишь растворения минеральных карбонатов недостаточно для поддержания рН в оптимальном диапазоне (8,0 — 8,3). Эти вопросы рассмотрены в разделе 7.4.
Микробиологические процессы. В результате микробиологических процессов, особенно в ходе диссимиляции неорганического азота анаэробными бактериями, в аквариумной воде образуются карбонатные и бикарбонатные ионы. При слабой циркуляции воды в активных точках частиц детрита происходит локальное увеличение щелочности и рН возрастает. Это может произойти на поверхности сильно заиленных фильтров при малом расходе воды. Когда рН на поверхности фильтра достигает 9, выделяемый гетеротрофными бактериями аммиак вступает в реакцию с ионами кальция с образованием осадка карбоната кальция и аммония. По данным Бернера (Вегпег, 1968), реакция имеет следующий вид:
Если рН находится в оптимальных пределах, свободная углекислота, образующаяся при дыхании животных и аэробных бактерий, вступает в реакцию с водой и аммиаком с образованием карбонатных и бикарбонатных ионов. Реакция имеет вид (Beriner, 1968):
7.2. Растворимость минеральных карбонатов.
Буферная активность воды частично зависит от растворимости карбонатов кальция и магния, которая в свою очередь определяется их концентрацией в растворе. На растворимость минеральных карбонатов отрицательное влияние оказывает присутствие в растворе магния и растворенных органических веществ (РОВ).
Магний. Магний, присутствующий в морской воде, затрудняет растворение и обсуждение минеральных карбонатов по двум причинам. Во-первых, он действует как поверхностный ингибитор на границе раздела кристаллической и жидкой сред, и, во-вторых, на поверхности кристаллов образуются наросты магниевого кальцита, препятствующего поверхностному растворению кристаллов. Фолк (Folk, 1974) и Липпманн (Lippmann, 1960) предположили, что магний затруднял рост кристаллов на поверхности кальцитов, действуя как ингибитор, а также оседая в точках роста на поверхности кристаллов как гидратированный ион. Кроме того, магний может включаться в растущие кристаллы, что увеличивает их растворимость. Новая поверхность кристаллов, состоящая не из чистого кальцита, а из магниевого кальцита, приходит в состояние равновесия с ионами магния в морской воде. Возникающие таким образом наросты дестабилизируют поверхностную структуру кристаллов и делают их более растворимыми (Berner, 1975; Plummer and Mackenzie, 1974; Weyl, 1967).
Чейв и др. (Chave et al., 1962) обнаружили, что из всех минеральных карбонатов насыщенные магнием кальциты обладают наибольшей растворимостью, за ними по убывающей следует арагонит, слабо насыщенные магнием кальциты, чистые кальциты. Доломиты, состоящие из кальция и магния в пропорции 1:1, отличаются наименьшей растворимостью.
На практике образование наростов магниевых кальцитов выравнивает растворимость различных минеральных карбонатов, уменьшая влияние их первоначального состава. По данным Бернера (Вегаег, 1975) и Вейла (Weyl,1967),рост магниевых кальцитов уравновешивается с концентрацией магния в окружающей морской воде. Для аквариумистов это означает, что морская вода в конечном счете является буфером для минералов. Таким образом, исходный состав минеральных карбонатов не играет решающей роли в поддержании нормальной щелочности морской воды. Присутствие в воде POB еще больше усложняет эту проблему.
Растворенные органические вещества (РОВ). Показано, что присутствующие в воде растворенные органические вещества затрудняют выпадение в осадок карбоната кальция из перенасыщенной естественной или искусственной морской воды (iBarcelena et al., 1976; Chase, 1965; Chave and Suess, 1967, 1970). Мейерс и Куинн (Meyers and Quinn, 1971),и Сьюсс (Suess, 197О) описали процесс осаждения жирных кислот и липидов на поверхности кальцитов. Покрывая поверхность карбонатных частиц, POB уменьшают число ионообменных участков.
При дыхании животные и растения выделяют углекислый газ (СО2). Некоторые биологические окислительные процессы увеличивают кислотность воды, другие, например денитрификация, повышают рН. Фотосинтез у растений - также восстановительный процесс, вызывающий повышение рН. В табл. 7.1 перечислены биологические процессы, так или иначе изменяющие рН воды.
Процессы биологического окисления в аквариумах преобладают над процессами восстановления, что вызывает постепенное понижение щелочности и рН воды. Минерализация органических соединений и их нитрификация являются основными кислотообразующими процессами бактериологического происхождения. Гундерсен и Маунтен (Gundersen and Mountain, 1973) показали, как накапливающиеся нитраты изменяют щелочность морской воды. Если реакцию нитрификации представить как процесс потери и приобретения электронов, то окисление ионов аммония выглядит следующим образом:
Из уравнения (23) следует, что при окислении 1 моль ионов аммония образуется 1 моль нитратных ионов и 1 моль ионов водорода. Иными словами, конечным продуктом нитрификации, строго говоря, является азотная кислота, а не нитратный ион, и именно она уменьшает буферную емкость воды. Из графика, приведенного на рис. 7.2, видно, как образование нитрат-ионов сопровождается возникновением эквивалентного количества ионов водорода. Титрование морской воды 0,01 н. HNO3 при одновременном контроле за рН показывает, что с нарастанием нитрификации рН линейно уменьшается.
7.4. Практическое руководство.
Влияние низкого рН на животных не совсем ясно. Большинство описанных в литературе исследований выполнялось при рН значительно ниже нормального, поэтому результаты не применимы к аквариумным системам. Повышенная концентрация свободной углекислоты, которой сопровождается пониженный рН, как известно, влияет на сродство крови к гемоглобина (см. раздел 5.2), однако большинство работ выполнялось в кислой или почти нейтральной среде. Напомним, что оптимальный диапазон рН в пресной воде 7,1 — 7,8, в морской и солоноватой — 8,0 — 8,3.
Добавляя в гравийный фильтр наполнитель, содержащий кальций, можно поддерживать реакцию воды выше нейтральной. Отношение кремниевого гравия к известковому должно составлять 4:1. Если своевременно удалять избыток детрита и очищать воду от растворенных органических веществ, окислительные бактериальные процессы подавляются и рН ниже 7,1 почти не бывает. Среди аквариумистов распространено мнение, что пресноводных тропических рыб следует содержать в подкисленной воде, предполагается, что этим имитируются естественные условия обитания (во многих лесных речках и ручьях вода кислая). Следует, однако, помнить, что животные при посадке в аквариум подвергаются многочисленным физиологическим стрессам, кислая вода является одним из них, так как в таком растворе возрастает парциальное давление СО2.
Поддерживать оптимальный рН в морской и солоноватой воде еще сложнее. Если для улучшения буферных свойств воды в замкнутых морских аквариумных системах использовать содержащий кальций гравий, рН установится на уровне 7,5, а щелочность 1,0 мэкв/л, т.е. оба показателя не достигают оптимальных значений. Для поддержания рН и щелочности в нормальном диапазоне раз в 2 недели необходимо заменять 10 воды и регулярно добавлять карбонат (Na2CO3) или бикарбонат (NaHCO3) натрия. Не рекомендуется применять толченый известняк. Если известняк применять достаточно долго, то содержащийся в нем кальций может повлиять на соотношение катионов в воде (Breder and Smith, 193i2).
Купер (Cooper, 1932) отмечал, что в результате использования известняка для коррекции рН в Плимутском аквариуме в Англии содержание кальция в воде достигло 0,62 г/л по сравнению с 0,39 г/л в естественной морской воде в районе Плимута.
Натрий как основной катион морской воды можно добавлять в виде карбоната или бикарбоната достаточно долго, не нарушая катионного баланса. Бредер и Смит (1932) подсчитали, что если все бикарбонатные ионы в морской воде Нью-Иоркского аквариума полностью заменить в течение 2,5 лет бикарбонатом натрия, содержание натрия возрастет всего на 0,5%. При использовании для этих целей известняка содержание кальция увеличится на 10% и станет почти в 20 раз выше молярной концентрации в свежей морской воде. Как отмечали Бредер и Смит (1932), ухудшение качества воды, связанное с применением известняка, наступает не сразу, однако лучше по возможности его избежать.
Глава 8
Токсичность различных веществ и профилактика заболеваний.
Основные проблемы токсичности, которые встречаются в аквариумной практике, связаны с действием азотистых соединений. Наиболее токсичны аммоний и нитриты. Нитраты наименее токсичны, однако они опасны, когда присутствуют в большом количестве и действуют достаточно долго. Токсичность нитритов в солоноватой и морской воде значительно ниже, чем в пресной.
Болезни как таковые в этой главе не рассматриваются, хотя в следующих разделах будет уделено определенное внимание контролю за факторами среды как средству предотвращения заболеваний водных животных. Общие вопросы болезней рыб и водных беспозвоночных достаточно полно освещены в многочисленных публикациях (Amlacher et а1., 1970; Bullock, 1971; Bullock et al., 1971; Dulin, 1976; Hoffman, 1967; Hoffman and Meyer, 1974; Johnson, 1978; Kabata, 1970; Kings-ford, 1975; Klontz, 1973; National Academy of Science, 1973; Pauley and Тпрр, 1975; Reichenbach-К11п1~е, Elkan, 1965; Sarig, 1971; Sindermann, 1977; Snieszko, 1970; van Duijn, 1973; Wellborn and Rogers, 1966). Обширная библиография приводится в работах Конроя (Conroy,1968), Джонсона (Johnson, 1968) и Зиндермана (Sindermamn, 197О). Проблемы иммунологии рыб обсуждали Андерсон (Anderson, 1974) и Лом (Lom, 1969), Рибелин и Мигаки (Ribelin and Migaki, 1975) опубликовали работу по патологии рыб.
Аммоний - наиболее токсичная форма из всех соединений неорганического азота, образующихся в аквариуме. Он образуется в воде в результате минерализации органических веществ гетеротрофными бактериями, а также как побочный продукт азотистого обмена гидробионтов (см. рис. 1.2).
Гидролиз аммония. Гидролиз аммония в природной воде, как показано ниже, идет при рК (константа равновесия) около 9, т.е. ионов аммония всегда больше, чем молекул свободного аммиака. Выявление факторов, влияющих на гидролиз аммония, очень важно, поскольку некоторые аквариумисты считают аммиак (NH3) более токсичным, чем ионы аммония (NH4+)
NH4 + H2O--><--NH3+H3O+ (24)
На ход реакции (24) оказывают влияние рН, температура и соленость, причем рН принадлежит решающая роль. Повышение рН на единицу вызывает десятикратное увеличение образования свободного аммиака. Повышение температуры воды и снижение солености увеличивают выделение аммиака не столь значительно. Температурный эффект обусловлен ускорением гидролиза ионов аммония при повышении температуры, влияние солености — уменьшением активности свободного аммиака в растворе возросшей ионной силы (Hampson, 1976). Таким образом, при одинаковой температуре, рН и содержании общего аммония (NH4-N) в растворе в морской воде содержится меньше NH3, чем в пресной (см. табл. 9.1).
Выделение аммония и его токсичность. Большинство водных животных являются аммонотелическими, т.е. свыше 50% азота выделяется у них в виде аммония преимущественно через жабры. Издавна считалось, что проникать в ткани может только аммиак (NH3), а аммоний такой способностью не обладает (Milne et al., 1958; Warren, 1962). В настоящее время от этой теории следует отказаться. Теперь стало ясно, что обе формы аммония способны проникать в ткани животных. Последние исследования доказали, что основной формой аммония, выделяемой через жабры рыбами и беспозвоночными, обитающими в воде любой солености, является NH4+ (Evans, 1973, 197i5; Kerstetter find Кее1ег, 1976; Maetz et а1., 197i6; Mangum et al., 1978; Рауап and Маей, 1973; Payan and Matty, 1975). Показано, что экскреция ионов аммония — обменный процесс, при котором метаболический NH4+ обменивается на поверхности жабр на ионы Na+ из воды. Значение экскреции аммиака окончательно не выяснено из-за отсутствия необходимой информации.
Механизм токсического действия аммония также должен быть пересмотрен. Ранее считалось, что токсичность связана с градиентом парциального давления аммиака при прохождении его через жабры. Предполагалось, что по мере увеличения парциального давления аммиака в воде NH3 диффундирует в организм животного по градиенту концентрации. Это могло быть так, если бы содержание NH3 в воде превышало его содержание в крови. Однако сейчас этот механизм выглядит сомнительным. Фромм и Жиллет (Fromm and Gillette, 1968) показали, что при содержании радужной форели (Salmo gairdineri) в воде с возрастающей концентрацией аммиака содержание его в крови также увеличивалось, однако оно всегда оставалось выше содержания NH3 во внешней среде. Этим авторам не удалось экспериментально доказать возможность проникновения аммиака в жабры рыб извне. Они предположили, что возрастание концентрации аммиака в воде вызывает усиленное накопление метаболического аммония в тканях, который и вызывает токсикоз. Косвенно эту гипотезу подтвердили Фромм и Жиллет (Fromm and Gillett, 1968) и Олсон и Фромм (Olson and Fromm, 1971), которые обнаружили, что интенсивность выделения аммония радужной форелью снижалась по мере возрастания содержания аммиака в воде. Дальнейшие эксперименты должны дать ответ на вопрос, каким образом аммиак проникает в жабры водных животных и вызывает отравление. До тех пор следует считать, что высокое содержание аммиака в воде оказывает косвенное токсическое действие, истинное отравление происходит из-за того, что животные не могут освободиться от избытка аммония, накапливающегося в ходе азотистого обмена.
рН воды оказывает влияние на токсичность аммиака, поскольку регулирует гидролиз NH4+. С повышением рН количество свободного аммиака возрастает пропорционально концентрации ионов аммония (NH4+), а аммиак, по мнению специалистов,— более токсичная форма (Armstrong et al., 1978; Burkhalter and Кауа, 1977; Fromm and Gillette, 1968; Hampson, 1976; Robinette, 1976; Robin, Elmaraghy, 1977; Schreckenbach et al., 1975). Обе формы аммония проникают через тканевый барьер, как уже отмечалось, обе ядовиты, хотя NH3 при высоком рН более токсичен, чем NH4+ (Armstrong et аl., 1978).
При низком содержании в воде растворенного кислорода токсичность аммония усиливается, хотя механизм этого явления не вполне ясен.
Рейхенбах-Клинке (Reichenbach-,Klinkе, 1967) отмечал, что в тканях некоторых видов европейских пресноводных рыб по мере возрастания концентрации NH3 содержание кислорода уменьшалось, в условиях дефицита кислорода в воде у рыб понижалась устойчивость к аммиаку. Некоторые другие исследователи подтверждают, что токсичность NH3 значительно возрастает в воде с пониженным содержанием кислорода (Downing and Merkens, 1955; Larmoyeux and Piper, 1973; Lloyd, 1961; Merkens and Downing, 1957; Smith, 1972; Smith and Piper, 1975; Wuhrmann and Woker, 1948, 1953).
Согласно одной из теорий высокое содержание аммиака в воде каким-то образом связано со способностью гемоглобина удерживать кислород. РейхеноахКлинке (Reichenbach-iKlinke, 1967) отметил уменьшение количества красных кровяных клеток у пресноводных рыб после того, как их выдерживали в воде с сублетальной концентрацией аммиака. Броквей (Brockway, 1950) сообщал, что когда концентрация NH4 - N в воде достигла 1 мг/л, содержание кислорода в крови радужной форели снизилось на 14% по сравнению с нормальным, а углекислоты - увеличилось почти на 15%. Вместе с тем Фромм и Жиллет (1968), исследуя in vitro эритроциты, помещенные в раствор Рингера, отмечали, что даже при повышении концентрации NH4 - N до 10 мг/л способность гемоглобина связывать кислород заметно не изменялась. Сауса и Мид (Sousa and Meade, 1977) изучали с помощью спектрофотометра раствор гемоглобина у кижуча, содержавшегося в воде с высокой концентрацией аммония. Они отметили постепенное смещение адсорбционной конфигурации насыщенного кислородом гемоглобина в сторону деоксигенации. Исследователи заключили, что длительное пребывание в среде, насыщенной аммиаком, ведет к ацидемии. Это в свою очередь нарушало способность гемоглобина переносить кислород. Ацидемия, сопровождающаяся нарушением внутреннего кислотно-щелочного баланса, ведет к преждевременному отщеплению кислорода (эффект Бора).
Содержащиеся в крови нитриты окисляют гемоглобин до метгемоглобина, который неспособен переносить кислород (Jaffe, 1964). Присутствие у рыб метгемоглобина можно определить по цвету крови и жабр, которые становятся коричневыми. Ранее предполагали, что появление в крови метгемоглобина коррелирует с повышенной смертностью водных животных, но это не всегда так, особенно если сопоставить смертность животных в морской и пресной воде в биопробе. Кроуфорд и Аллен (Crawford and Allen, 1977) показали, что 70% сеголетков чавычи, содержавшихся в пресной воде с концентрацией NO> — N 8,18 мт/л, погибали при содержании метгемоглобина 44%. Смертность той же молоди, находившейся в морской воде с концентрацией NO2 — N 246,97 мг/л, составила всего 10% при концентрации метгемоглобина в крови 74%.
В табл. 8.1 представлены некоторые опубликованные данные по токсичности нитритов в пресной, солоноватой и морской воде. Хорошо заметно, что по мере возрастания солености среды смертность животных уменьшается. Кроуфорд и Аллен (1977) объясняли это защитным действием ионов кальция, однако не исключали возможности сходного влияния и других присутствующих ионов. Перрону и Миду (Perrone and Meade, 1977) удалось доказать, что защитную функцию выполняют хлориды. Смертность годовиков кижуча, которых в течение 48 ч выдерживали в воде с содержанием нитритов (в виде NO2 — N) 29,8 мг/л и хлоридов (в виде Cl) 261,3 мг/л, не отмечена. При выдерживании другой группы в воде с концентрацией NO2 — N 3,8 мг/л и хлоридов 2,5 мг/л уже через 12 ч погибло 58,3% всей молоди. Механизм действия защитных ионов неясен, но возможно, что катионы, присутствующие в соленой воде, соединяясь нитритами, препятствуют их поглощению рыбой из раствора. Ионы хлора могут непосредственно заметить ионы нитритов, а поскольку их концентрация в растворе значительно выше, хлориды затрудняют ассимиляцию нитритов. Нитриты при любой концентрации не представляют серьезной угрозы для животных в морских и солоноватоводных аквариумах, однако их присутствие в пресной воде даже в малых количествах, безусловно, очень опасно.
Нитраты даже в больших концентрациях не являются остротоксичными для водных животных, хотя их действие на протяжении длительного времени не изучалось. Возможно, что бледная окраска жабр, развивающаяся у рыб спустя несколько месяцев содержания в аквариуме, - результат действия накапливающихся нитратов, однако это только предположение.
Кнепп и Аркин (Knepp and Arkin, 1973) сообщали, что присутствие в воде нитратов NО3 — N в концентрации 400 мг/л не оказывало влияния на выживаемость и рост пресноводных большеротого окуня (Micropterus salmoides) и канального сомика (Ictalurus punctatus). Более высокие концентрации не изучались. Уэстин (Westin, 1974) определил, что для чавычи (Oncorhynchus tshawytscha) и радужной форели, содержавшихся прecной воде, нитраты в 2000 раз менее токсичны, чем нитриты. У чавычи признаки расстройства функций при концентрации нитратов NО3-N 1000 мг/л или несколько меньше наблюдались на пятый-восьмой день. Они выражались в неспособности плавать по прямой, затрудненном дыхании, пониженной активности, в сочетании с нескоординированными движениями. У некоторых рыб жаберные лепестки приобретали цвет от бледно-розового до темного красно-коричневого. Было отмечено, что нитраты более токсичны в солоноватой (15%о) воде. Для лососей токсичность нитратов была в 1,14 — 1,41 раза выше при содержании в солоноватой воде, чем в пресной. Для адаптированной к солоноватой воде форели токсичность нитратов оказалась в 1,24 — 1,38 раза выше, чем в пресной воде.
Хираяма (Hirayama, 1966) отмечал увеличение дыхательной активности у обыкновенного осьминога (Octopus vulgaris), которого поместили в морскую воду с пониженной щелочностью и рН и высоким содержанием нитратов. Животное погибло спустя 7 ч при содержании нитратов 1400 мг/л. Куватани и др. (Kuwatani et al., 1969) пришли к выводу, что нитраты в концентрации 1000 мг/л не оказывают влияния на рост моллюска японской жемчужницы (Pinctata fucada) до тех пор, пока рН морской воды остается выше 8,05.
Эпифанио и Срна (Epifanio and Srna, 1975) показали, что высокая концентрация нитратов не оказывала вредного влияния на развитие двух видов двустворчатых моллюсков, содержавшихся в слабосоленой морской воде (8=27%о). При экспозиции 96 ч ЛД50 нитрата натрия для взрослых особей американской устрицы (Crassostrea virginica) составила 2604 мг/л и 3794 мг/л для молоди. Даже когда концентрация NaNO3 достигала 75% общей солености, не удалось вызвать 50%-ную гибель двустворчатого моллюска венуса (Nercenaria тегсепаIia). Исследователи решили, что испытывать более высокие концентрации нет необходимости.
8.4. Токсичность тяжелых металлов.
Основные тяжелые металлы (Cr, Pb, Hg, Cu, Zn) присутствуют в воде в ничтожно малых количествах. Если их концентрация возрастает (оставаясь очень низкой), все они становятся токсичными для водных животных. Многие из них вызывают гибель гидробионтов при концентрации менее 1,0 мг/л. В этом разделе рассмотрено действие двух тяжелых металлов: цинка и меди, так как их часто применяют для лечения заболеваний морских рыб, вызванных простейшими.
Через некоторое время после внесения в аквариум токсичность цинк или медьсодержащих веществ снижается, так как ионы тяжелых металлов оседают в виде кароонатов. Эффективность осаждения тяжелых металлов зависит не от жесткости воды или концентрации катионов, а от ее щелочности. В растворенном виде, как цинк, так и медь вызывают у рыб обильное выделение слизи. Слизь выделяется в воду вместе с инцистированными формами некоторых паразитов. Считалось, что паразитические простейшие, например Cryptocarion irritans, более восприимчивы к действию тяжелых металлов на стадии «бродяжек», поэтому обработка цинком или медью нейтрализует эти организмы прежде, чем они прикрепятся к хозяину. Однако в лабораторных условиях in vitro это не подтвердилось.
У рыб, подвергшихся действию токсических концентраций меди и цинка, резко усиливается дыхательная активность (Jones, 1938, 1939; Sellers et al., 1975). Некоторые исследователи отмечали, что тяжелые металлы, нарушая нормальный газообмен, вызывали гипоксию (кислородное голодание) тканей (Ellis, 1937; Skidmore,1964; Vernon, 1954). Бертон и др. (Burton et al., 1972) пришли к выводу, что основной причиной гибели рыб, обработанных медью, является гипоксия тканей, вызванная коагуляцией и оседанием слизи на жабрах и сопровождающаяся повреждением клеток тканей жабр. Гистопатологические изменения жаберной ткани у рыб, подвергавшихся действию тяжелых металлов, описаны в литературе. Так, Бейкер (Baker, 1969) отмечал, что у зимней камбалы (Pseudopleuronectes americanus) под действием невысокой концентрации меди жаберные лепестки сморщиваются, эпителиальный слой вакуолизирован, число слизеобразующих клеток в жаберных лепестках уменьшается. Маттиосен и Брефилд (Matthiessen and Brafield, 1973) заметили сражение вторичного плоского эпителия у трехиглой колюшки (Gasterosteus aculeatus) под действием цинка.
Тяжелые металлы вызывают и другие опасные поражения, включая ослабление активности ферментов (Christensen, 19?1, 1972; Jackim et al., 1970), нарушение ионной регуляции (Lewis and Lewis, 1971), гипергликемию или увеличение содержания глюкозы в крови (Watson and NcKeown, 1976) и другие изменения гематологических показателей (Cardeilhac and Hall, 1977; McKim et al., 1970). Гарднер и Лярош (Gardner and LaiRoche, 1973) сообщали, что под действием меди наблюдаются изменения клеток механорецепторов канала боковой линии на голове взрослых особей фундулуса (Fundulus heteroclitus) и атлантической атерины (Nenidia menidia), а также поражения зрительных органов и почек, геморрагия мозга и прилежащих к нему периорбитальных тканей.
8.5. Иммунитет рыб и внешняя среда.
Несмотря на обширную литературу по лечению заболеваний водных животных, о профилактике заболеваний путем тщательного контроля за внешней средой написано сравнительно мало. В данном разделе сделана попытка установить причинно-следственные связи инфекционных заболеваний и условий обитания. Естественно, любая попытка такого рода не претендует на полноту исследования, поскольку зависимости между заболеваниями и стрессовыми факторами не вполне очевидны.
Данные, приведенные в предыдущих главах, свидетельствуют о том, что водные животные чутко реагируют на малейшие изменения качества воды. Следует еще раз отметить, что хотя большинство гидробионтов способны до некоторой степени регулировать свои ответные реакции на изменения внешней среды, в неволе эти реакции многократно усиливаются. В природе естественное распределение паразитов и хозяев позволяет видам-хозяевам выжить, хотя под действием неблагоприятных факторов много отдельных особей может погибнуть. В условиях изоляции плотные посадки способствуют распространению паразитов. При недостаточном контроле за качеством воды паразиты могут так размножиться, что полностью уничтожат своих хозяев. В этих условиях любые защитные системы хозяев быстро подавляются преобладающим числом инфекционных организмов.
Патогенные организмы присутствуют у всех водных животных, однако подлинную опасность в аквакультуре представляют инфекционные формы. Степень поражения зависит главным образом от физиологического состояния хозяина, а оно в свою очередь определяется условиями внешней среды. У здоровых животных инфекция находится в латентном (скрытом) состоянии, паразиты присутствуют, но не вызывают заболеваний. Возбудителями большинства эпизоотий в аквариумах являются бактерии и простейшие. Численность этих организмов можно поддерживать на безопасном уровне путем строгого контроля за качеством воды.
Вирулентность гельминтов и ракообразных паразитов в меньшей степени зависит от качества среды обитания хозяина. Тяжелым поражениям зачастую подвергаются внешне здоровые животные, несмотря на контроль за такими гидрохимическими показателями, как температура, содержание растворенного кислорода и аммония. Заболевших животных приходится лечить.
Паразитические бактерии, простейшие, а также вирусы представляют в аквариумах большую опасность, чем гельминты и ракообразные паразиты. Методы борьбы с последними описаны ниже. Бактерии и простейшие обычно поселяются на жабрах и внутренних полостях гидробионтов. Останутся они в латентной форме или станут инфекционными, зависит от физиологического состояния хозяина. Временное уменьшение содержания кислорода, увеличение концентрации свободной углекислоты, аммиака и, очевидно, растворенных органических веществ (РОВ) ослабляют хозяина. По мере увеличения концентрации общего растворенного углерода размножаются гетеротрофные бактерии, и если их окажется достаточно много, обычно безопасные формы могут стать инфекционными. Колебания температуры вызывают стрессовое состояние у животного-хозяина, что впоследствии приводит к хроническому поражению простейшими паразитами зачастую уже после того, как температура пришла в норму.
Бактериальные и протозойные инфекции часто развиваются тогда, когда в сбалансированный аквариум подсаживают новых животных. Широко распространено мнение, что болезнетворные микроорганизмы привносятся вместе с новыми животными и передаются акклиматизированным особям, однако проблема оказалась гораздо сложнее. Например, если «старожилы» и вновь подсаженные особи поражены одним возбудителем, но в скрытой форме, посадка новых животных может вызвать переход латентной инфекции в болезнетворную. Причины могут быть разными, например повышение концентрации аммиака при временном изменении производительности фильтра, возрастание содержания РОВ или увеличение концентрации СО2 в плохо забуференной зоне. Другими словами, первопричиной гибели животных являются изменения гидрохимических показателей воды, хотя заметным обстоятельством является только подсадка животных. Как показано на рис. 8.1, ухудшение качества воды снижает устойчивость хозяина к болезни и способствует переходу возбудителя из латентюй формы в инфекционную.
Слизь на внешних покровах водных животных защищает их от проникновения эктопаразитов и позволяет поддерживать соотношение паразит — хозяин в пользу хозяина. Доказано, что слизь содержит антитела, которые уничтожают паразитических простейших (Lom, 1969). Синтез антител в организме холоднокровных животных зависит от температуры воды. В зависимости от вида рыбы общее количество антител в слизи уменьшается при отклонении температуры в ту и другую сторону от оптимального уровня. Лом (Lom, 1969) отмечал, что при повышении температуры воды до 20' триходины отпадали от карпа, так как «...защитные свойства слизи проявляются только при повышенной температуре». При 10С рыба неспособна самостоятельно освободиться от паразитов, хотя рост триходин при низкой температуре замедлен.
Колебания температуры воды и накопление вредных продуктов обмена — вот две основные причины, вызывающие вспышки инфекционных заболеваний и инвазий.
8.6. Профилактика заболеваний.
Профилактические мероприятия сводятся к поддержанию благоприятных условий среды (включая качество воды и постоянную температуру); стерилизации циркулирующей в аквариуме воды; обеспечению нормального питания рыб и предупреждению попадания в систему инфекционных организмов извне. Первые два фактора рассматривались в предыдущих главах. Обсуждение третьего не входит в задачу данной книги, а четвертый рассмотрен ниже.
Сырая вода. В природной необработанной воде присутствуют множество болезнетворных организмов, поэтому никогда не следует заполнять систему водой непосредственно из естественных источников. Сменную воду для аквариума следует предварительно профильтровать на быстром песчаном фильтре для удаления первичных взвесей. Затем ее пропускают через диатомовый фильтр. Диатомовый фильтр — эффективное средство против бактерий и простейших, которые прошли через песчаный фильтр. Затем воду в течение 2 недель держат в затененном баке и умеренно аэрируют.
Большинство паразитов за это время погибают из-за отсутствия хозяев. Это означает, что для замены 10% воды, которая производится раз в 2 недели в каждом аквариуме, необходимы, по крайней мере, два бака с достаточным количеством воды. Вместимость каждого бака должна быть достаточной для подключения к системе нового аквариума.
В замкнутых системах предварительная фильтрация сырой воды осуществляется периодически, фильтры используются непродолжительное время. Система предварительной очистки (последовательно установленные песчаный и диатомовый фильтры в комплексе) должна быть спроектирована так, чтобы фильтры могли работать по замкнутому циклу независимо от накопительных баков и аквариумов. Такое устройство схематически показано на рис. 8.2 пунктирными линиями. На рис. 8.2 показан также стерилизатор (УФ-лампа или озонатор). Перед подачей в аквариум вода после двухнедельного отстаивания должна пройти через стерилизатор. Сразу после обработки порции воды систему предварительной очистки дезинфицируют химическими веществами, промывают и держат сухой до следующей фильтрации. Стерилизация озоном или УФ-лучами для обеззараживания системы в этом случае неэффективна, так как неспособна нейтрализовать микроорганизмы, находящиеся в глубине песчаного слоя, а также бактерий на фильтровальных элементах, стенках и трубах диатомового фильтра. Лучшее средство для дезинфекции фильтров — хлорирование, необходимо только тщательно удалять все следы хлора после очистки.
Хлорирование системы предварительной очистки.
1. Воду переключают так, чтобы система предварительной очистки функционировала как замкнутая.
2. Промывают диатомовый фильтр обратным током воды. (Без грунтовки).
3. Добавляют гипохлорит натрия, чтобы содержание свободного хлора составляло 50 мг/л (методику см. American Water Works Association et al., 1975) .
4. Включают насосы и пропускают хлорированную воду через фильтры в замкнутом режиме в течение 2 ч.
5. Добавляя в воду тиосульфат натрия (Na2S203), доводят содержание свободного хлора до нуля. Количество тиосульфата может варьировать и поэтому для каждого конкретного случая определяется опытным путем.
6. Спускают воду из фильтров и оставляют их сухими до обработки следующей порции сырой воды.
7. Во время нового цикла очистки прежде, чем отводить воду в бак-накопитель, промывают систему сильной струей воды в течение 30 мин.
Подсадка животных. Новые партии животных следует подсаживать в основную систему только после того, как они пройдут карантин в течение 4 недель, и станет ясно, что они свободны от инфекционных микроорганизмов или внешних паразитов.
Живые корма. Если живые корма выращивают в искусственных условиях, они полностью безопасны. Так, широко культивируемая артемия (Artemia salina) пригодна для кормления как пресноводных, так и морских животных. Живые корма, заготовленные в естественных водоемах,— потенциальные носители паразитов. Во всех случаях кормовые организмы соленых вод нельзя скармливать морским и солоноватоводным видам животных, пресноводные пищевые организмы не следует скармливать видам, обитающим в пресной воде. Дело в том, что паразиты, обитающие на морских кормовых организмах, редко выживают в пресной воде, именно поэтому они безопасны для пресноводных животных. И наоборот, пресноводные формы, например Daphnia, безопасны для морских животных. Хищным пресноводным видам не следует давать мелких карповых рыб, хотя они безопасны для морских рыб. Во всех случаях с точки зрения предупреждения распространения заболеваний готовые искусственные смеси предпочтительнее живых кормов или мороженой рыбы.
Без надлежащего контроля процессы поддержания стабильных условий внешней среды и лечения заболеваний являются взаимоисключающими. Слишком поспешное применение лечебных средств может усугубить и без того сложную ситуацию, уничтожив полезные микроорганизмы фильтровального слоя. В этом случае качество воды быстро ухудшается, и неблагоприятная ситуация еще более осложняется. Проводя любые лечебные мероприятия, следует помнить о возможных последствиях ухудшения качества воды. В неумелых руках урон от лечения может быть больше, чем от болезни. В большинстве случаев не стоит лечить животных, пораженных бактериями или простейшими. Гибель рыбы от этих организмов, как уже отмечалось выше, часто вызвана неблагоприятными условиями внешней среды. Тяжелопораженных животных следует удалить, а все силы сосредоточить на исправлении сложившейся гидрохимической ситуации. В улучшенных условиях умеренно пораженные животные обычно выживают.
Гельминты и ракообразные паразиты более устойчивы к иммунным реакциям хозяев, с ними сложнее бороться одним лишь улучшением качества воды. Единственный надежный способ избавиться от этих паразитов — высадить всех животных и прохлорировать аквариум и фильтрационную систему. При двухчасовой экспозиции вполне достаточна концентрация свободного хлора 50 мг/л. Для ликвидации следов хлора добавляют тиосульфат натрия, систему осушают и тщательно промывают водопроводной водой. Затем аквариум следует заполнить свежеприготовленной водой и снова сбалансировать, используя акклиматизированных животных, прошедших карантин. Эта процедура, безусловно, трудоемка, но эффективна. При наличии строгого контроля за качеством воды тяжелые поражения гельминтами и ракообразными паразитами встречаются крайне редко.
Вопросы выбора лекарственных средств для лечения конкретных заболеваний широко обсуждались в литературе, поэтому здесь рецепты не приводятся. Однако при выборе лекарств следует учитывать следующее: лекарства должны быть максимально специфичными для данной инфекции; лекарственных средств, которые вызывают у водных животных обильное выделение слизи, необходимо избегать. Если удалить слизь, животные оказываются беззащитными перед повторным заражением другими микробами. По этой причине тяжелые металлы рекомендуется применять очень осторожно. Заболевших животных ни в коем случае нельзя лечить прямо в аквариуме. Некоторые физиотерапевтические средства подавляют нитрификацию (см. раздел 1.2). Именно поэтому бассейны для лечебной обработки, оборудованные биологическими фильтрами, редко функционируют нормально.
8.8. Практическое руководство.
Данные, подтверждающие повышенную токсичность аммиака (NH3) по сравнению с ионами аммония (NH4+), были получены в опытах с биопробой на уровне целых организмов (Lloyd and Orr, 1969; Wuhrmann and Poker, 1948). Этот факт можно будет считать доказанным, если такие же различия в токсичности будут установлены на клеточном уровне. Вопрос, однако, представляет чисто академический интерес, поскольку условия, определяющие гидролиз аммония в аквариуме (рН, температура и соленость), невозможно изменить, не вызывая других опасных последствий. Например, данные о том, что аммиак менее токсичен при низком рН, малоутешительны для специалистов, занимающихся морским аквариумом. Опыт показывает, что морские животные по непонятной причине лучше себя чувствуют при рН 8 и выше. Возможно, в этом диапазоне рН обменные процессы через жабры и наружные покровы наиболее эффективны. Температуру и соленость необходимо поддерживать в строгих пределах, что важно уже само по себе. Резкие изменения температуры воды оказывают отрицательное влияние на ферментативные системы пойкилотермных животных. Нельзя увеличивать ионную силу пресной аквариумной воды (повышать соленость) для уменьшения концентрации свободного аммиака.
Температуру, рН и соленость необходимо поддерживать в определенных пределах в соответствии с экологическими и физиологическими потребностями аквариумных животных и растений. Интенсивная аэрация позволяет ослабить токсическое действие аммиака на водных животных. Удаление несъеденных остатков пищи, погибших животных и растений, регулярная замена части воды в аквариуме, умеренные плотности посадки животных и растений — наиболее эффективные средства предупреждения увеличения концентрации аммиака в растворе. Верхний предел содержания общего аммония не должен превышать 0,1 мг/л.
Нитриты остротоксичны, по-видимому, только в пресной и слабосоленой воде, однако это заключение основывается на ограниченных данных, поэтому верхний предел содержания нитритов в любых аквариумах не должен превышать 0,1 мг NO2-N/л. Данные о длительном воздействии нитратов на водных животных отсутствуют, а их кратковременным воздействием можно пренебречь, так как нитраты не относятся к высокотоксичным соединениям. Вместе с тем при высоких концентрациях нитраты не могут не оказывать вредного влияния, поэтому их содержание не должно превышать 20 мг NO3 — N/л. Ограничение содержания в воде нитратов достигается регулярной заменой части воды и посадкой в аквариум растений, которые периодически удаляются по мере отрастания *.
* Прим. ред. Большинство современных исследователей считают допустимым содержание значительных количеств нитратов в системах с оборотным водоснабжением при выращивании тепловодных рыб. Например, по данным Л. Нэгеля, Ч. Меске и Х. Мудрака (Nagel, Meske and Mudrack, 197б), двухлетки карпа нормально росли при концентрации 1000 — 1800 мг Nos — N/л, достигая за 6 мес средней массы 900 г.
Опыт показывает, что лечение рыб тяжелыми металлами не дает положительных результатов. В большинстве случаев неблагоприятное воздействие этих средств на хозяина сводит на нет положительный эффект от удаления паразитов. До сих пор не установлены летальные дозы меди или цинка для некоторых видов морских рыб. Обработка аквариума, в котором содержится сразу много видов, особенно недопустима, поскольку длительность действия и летальные дозы у разных видов рыб резко различаются. Более того, до сих пор неясно, как действуют тяжелые металлы на разных стадиях жизненного цикла паразита, т.е. обработка может оказаться более опасной для хозяина, чем для паразита.
Количество меди или цинка, которое остается после обработки аквариума в растворенном состоянии, трудно определить. Накопление детрита на поверхности фильтра наряду с высокой концентрацией растворенных органических веществ в толще воды оказывает значительное влияние на дозу цинка и меди, которую способны переносить микроорганизмы и аквариумные животные и растения. Известно, что органическое вещество активного ила, связывая медь, уменьшает ее токсическое действие на нитрифицирующих бактерий (Tomnsson et al., 1966). Образование комплексных циклических соединений меди (хелатов), очевидно, делает ее менее токсичной для пресноводных рыб (Doudoroff and Katz, 1953). Фитцджеральд (Fitzgerald, 1963) показал, что реакция сульфата меди с лимонной кислотой с образованием хелата уменьшает токсическое действие меди на пимефалес (Pimephales notatus) в 500 раз. Образование хелатных соединений способствовало удержанию 90% меди,в растворенном состоянии при рН 6,0 и 8,5.
Хелатные комплексы меди и цинка применяют при обработке морских аквариумов, когда требуется продлить действие меди в растворенном состоянии. Устойчивые к действию хелатов тяжелых металлов гетеротрофные бактерии часто разрушают органическую основу хелатных молекул, в результате освободившиеся ионы тяжелых металлов соединяются с карбонатами и выпадают в осадок (инактивируются). Знаменательно, что ни в одном из рекомендуемых для обработки морских аквариумов нормативов не учитывается растворенное органическое вещество (РОВ) как фактор, изменяющий токсические свойства ионов металлов. Образование хелатов, как уже отмечалось, уменьшает токсическое воздействие тяжелых металлов на рыб. По-видимому, их действие на паразитов аналогично (Spotte, 1970).
Токсичность тяжелых металлов проявляется в затруднении дыхания и гипоксии тканей животных, поэтому любая обработка воды солями меди или цинка должна сопровождаться усиленной аэрацией. Больных рыб необходимо высадить из аквариума и обработать в отдельном контейнере. Следует проследить, чтобы в контейнере не было содержащего кальций гравия, а в воде отсутствовали растворенные органические вещества. Выпавшие в осадок тяжелые металлы невозможно удалить традиционными способами (например, частичной заменой воды или физической адсорбцией). Воду, обработанную тяжелыми металлами, не следует подвергать очистке активированным углем или в пеноотделительных колонках, так как и в том и в другом случае из раствора быстро извлекаются хелатные соединения этих металлов. Озонирование может также разрушить органическую основу молекул, содержащих тяжелые металлы, освобождая тем самым ионы металлов, которые соединяются с карбонатами и выпадают в осадок.









 Алиэкспресс аквариумные
Алиэкспресс аквариумные